单选题
人类的一切活动都离不开能量,下列化学反应属于吸热反应的是( )
- A、 3MnO2(s)+4Al(s)=2Al2O3(s)+3Mn(s)
- B、 Fe(s)+2HCl(aq)=FeCl2(aq)+H2(g)
- C、 C(s)+CO2(g)=2CO(g)
- D、 2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)
研究表明,在一定条件下,气态HCN(a)与CNH(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是( )

- A、 CNH比HCN更稳定
- B、 HCN(g)→CNH(g)为吸热反应,但反应条件不一定要加热
- C、 1molHCN(g)中的所有化学键全部断开需要放出127.2kJ的热量
- D、 1molHCN(g)转化为1molCNH(g)需要吸收56.3kJ的热量
已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1。下列说法正确的是( )
- A、 1L1mol·L-1盐酸和1L1mol·L-1氨水反应放出热量为57.3kJ
- B、 1L1mol·L-1高氯酸溶液和1L1mol·L-1NaOH溶液反应放出热量为57.3kJ
- C、 含0.5molH2SO4的浓硫酸和1L1mol·L-1NaOH溶液反应放出热量为57.3kJ
- D、 1L0.5mol·L-1稀硫酸和1L0.5mol·L-1Ba(OH)2溶液反应放出热量为57.3kJ
下列关于反应能量的说法正确的是( )
- A、 一定条件下:①2SO2(g)+O2(g)
2SO3(g) △H1;②2SO3(g)
2SO2(g)+O2(g) △H2 , 则△H1<△H2
- B、 相同条件下,若1molH(g)具有的能量为E1 , 1molH2(g)具有的能量为E2 , 则有2E1=E2
- C、 甲烷的燃烧热△H=-890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
- D、 已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1 , 则1molNaOH固体与含0.5molH2SO4的稀硫酸混合放出57.3kJ的热量
“世上无难事,九天可揽月”,我国的航空航天事业取得了举世瞩目的成就。碳酰肼类化合物[Mn(L)3](ClO4)2是种优良的含能材料,可作为火箭推进剂的组分,其相关反应的能量变化如图所示,已知△H2=-299kJ·mol-1 , 则△H1(kJ·mol-1)为( )
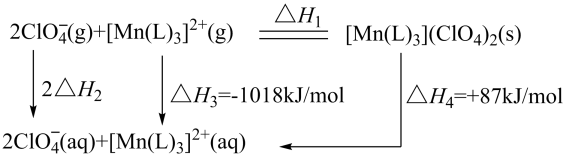
- A、 -1389
- B、 -1334
- C、 -1703
- D、 -1563
在C(s)+CO2(g)=2CO(g)的反应中,现采取下列措施:①增加碳的量②缩小体积,增大压强③通入CO2④恒容下充入N2⑤恒压下充入N2 , 上述能够使反应速率增大的措施是( )
- A、 ①④
- B、 ②③
- C、 ①③
- D、 ②④
下列说法中错误的是( )
- A、 对有气体参加的化学反应,增大压强使容器容积减小,可使单位体积内活化分子数增加,因而化学反应速率增大
- B、 活化分子之间发生的碰撞不一定是有效碰撞
- C、 增大反应物浓度,可使反应物分子中活化分子的百分数增大,从而增大化学反应速率
- D、 加入适宜催化剂,可使反应物分子中活化分子的百分数增大,从而增大化学反应速率
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g) H2(g)+I2(g)。HI起始浓度为0.20mol/L,若c(HI)由0.18mol/L降到0.14mol/L时,需要20s,那么c(HI)由0.20mol/L降到0.18mol/L时,所需反应的时间为( )
H2(g)+I2(g)。HI起始浓度为0.20mol/L,若c(HI)由0.18mol/L降到0.14mol/L时,需要20s,那么c(HI)由0.20mol/L降到0.18mol/L时,所需反应的时间为( )
- A、 等于10s
- B、 小于10s
- C、 大于10s
- D、 以上答案都错误
已知C粉和H2O(g)在恒温恒容的密闭容器中,发生反应C(s)+H2O(g) CO(g)+H2(g) △H>0。反应达到平衡时,下列叙述正确的是( )
CO(g)+H2(g) △H>0。反应达到平衡时,下列叙述正确的是( )
- A、 充入一定量的氩气,n(H2)减少
- B、 更换高效催化剂,CO的产率增大
- C、 再加入一定量的C粉,H2的体积分数增大
- D、 再充入一定量的H2O(g),H2O(g)转化率减小
图中的曲线是反应2A(g)+B(g) 2C(g) △H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )
2C(g) △H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )

- A、 Q<0
- B、 平衡常数值:b点<d点
- C、 T1温度下若由a点达到平衡,可以采取增大压强的方法
- D、 c点v(正)<v(逆)
已知下列反应的平衡常数:H2S(g)=H2(g)+S(s) K1;S(s)+O2(g)=SO2(g) K2;则反应H2(g)+SO2(g)=O2(g)+H2S(g)的平衡常数是( )
- A、 K1+K2
- B、 K1-K2
- C、
- D、
如图所示,初始体积均为1L的两容器,甲保持恒容,乙保持恒压。起始时关闭活塞K,向甲中充入1molPCl5(g),乙中充入1molPCl3(g)和1molCl2(g)。恒温下,均发生反应:PCl5(g) PCl3(g)+Cl2(g)。达平衡时,乙的容积为0.8L。下列说法错误的是( )
PCl3(g)+Cl2(g)。达平衡时,乙的容积为0.8L。下列说法错误的是( )

- A、 平衡时PCl5(g)的体积分数:甲<乙
- B、 从乙中移走0.5molPCl3(g),0.5molCl2(g),再次平衡时乙中n(PCl5)=0.2mol
- C、 打开K一段时间,再次平衡时乙容器的体积为0.6L
- D、 甲中PCl5(g)的转化率小于60%
已知凡气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是( )
- A、 3O2(g)=2O3(g) △H>0
- B、 2C(s)+O2(g)=2CO(g) △H<0
- C、 N2(g)+3H2(g)
2NH3(g) △H<0
- D、 CaCO3(s)=CaO(s)+CO2(g) △H>0
可逆反应2A+B(s) C达到平衡后,加压或升温,A的转化率都增大,则下列结论一定正确的是( )
C达到平衡后,加压或升温,A的转化率都增大,则下列结论一定正确的是( )
- A、 A为非气体,C为气体,正反应为放热反应
- B、 A为气体,C的状态不确定,正反应为吸热反应
- C、 A、C均为气体,正反应为吸热反应
- D、 A为气体,C为非气体,正反应为放热反应
某温度下,反应H2(g)+Br2(g) 2HBr(g)的平衡常数为1×103 , 则该温度下,反应4HBr(g)
2HBr(g)的平衡常数为1×103 , 则该温度下,反应4HBr(g) 2H2+2Br2的平衡常数为( )
2H2+2Br2的平衡常数为( )
- A、 1×103
- B、 1×10-3
- C、 1×10-6
- D、 1×106
定条件下,合成氨反应为:N2+3H2 2NH3。图1表示能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响,下列说法错误的是( )
2NH3。图1表示能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响,下列说法错误的是( )



- A、 升高温度,该反应的平衡常数减小
- B、 由图2信息,10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1
- C、 由图2信息,从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d
- D、 图3中温度T1<T2 , a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
