选择题
通过以下反应可获得新型能源二甲醚(CH3OCH3 ).下列说法不正确的是( )
①C(s)+H2O(g)═CO(g)+H2 (g) △H1=a kJ•mol﹣1
②CO(g)+H2O(g)═CO2(g)+H2 (g) △H2=b kJ•mol﹣1
③CO2 (g)+3H2 (g)═CH3OH(g)+H2O(g) △H3=c kJ•mol﹣1
④2CH3OH(g)═CH3OCH3 (g)+H2O(g) △H4=d kJ•mol﹣1
- A、 反应①、②为反应③提供原料气
- B、 反应③也是 CO2资源化利用的方法之一
- C、 反应CH3OH(g)═
CH3OCH3 (g)+
H2O(l)的△H=
kJ•mol﹣1
- D、 反应 2CO(g)+4H2 (g)═CH3OCH3 (g)+H2O(g)的△H=( 2b+2c+d ) kJ•mol﹣1
相同温度和压强下,关于反应的 , 下列判断正确的是( )
, 下列判断正确的是( )
- A、
,
- B、
- C、
- D、
甲醇脱氢分解反应是一个涉及多个中间体的复杂反应。甲醇分子在催化剂Pt表面发生吸附后,其分解的第一步即为分子中的C—H、C—O或者O-H键活化解离,引发催化分解反应进行。Pt表面上甲醇分子中C—H、C—O和O—H活化解离的势能变化如图(其中吸附在催化剂表面的物种用*标注)所示。下列说法错误的是( )

- A、 CH3OH*→CH3*+OH*△H>0
- B、 CH3OH*活化解离成不同中间体不一定都吸热
- C、 CH3OH*比气态甲醇稳定
- D、 选用合适的催化剂可以提高甲醇的脱氢效率
反应2N2H4(1)+2NO2(g)=3N2(g)+4H2O(1)ΔH=-1135.7 kJ·mol可为火箭发射提供能量。下列有关该反应的说法正确的是( )
- A、 反应消耗32gN2H4(1)放出1135.7kJ的能量
- B、 反应物中所有化学键键能之和大于生成物中所有化学键键能之和
- C、 每生成18g水,反应中转移电子物质的量为4mol
- D、 常温下该反应可自发进行
CO2催化加氢是碳中和的重要手段之一,以下是CO2加氢时发生的两个主要反应:
反应I:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1=-165.0kJ·mol-1
反应II:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2
在体积为VL的两个恒容密闭容器中,分别按表所示充入一定量的CO2和H2.平衡体系中 和
随温度变化关系如图所示。
| 容器 | 起始物质的量/mol | |
| CO2 | H2 | |
| 甲 | 0.1 | 0.3 |
| 乙 | 1 | 3 |

下列有关说法正确的是( )
- A、 ΔH2<0
- B、 曲线b表示乙容器中
随温度的变化
- C、 M点对应H2的总转化率为66.7%
- D、 590℃条件下反应10min,某容器中
=2.4.此时,反应II的V正>V逆
反应  分两步进行:Ⅰ.
分两步进行:Ⅰ.  ,Ⅱ.
,Ⅱ.  ,其反应过程能量变化如图1所示。在其它条件相同时,分别在
,其反应过程能量变化如图1所示。在其它条件相同时,分别在  和
和  测得c(NO)随时间(t)的变化关系如图2 所示。下列说法错误的是( )
测得c(NO)随时间(t)的变化关系如图2 所示。下列说法错误的是( )
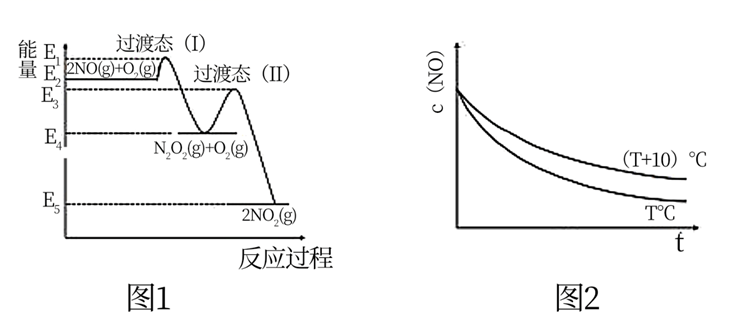
- A、
- B、 反应Ⅱ是总反应的决速步骤
- C、 升高温度总反应速率一定增大
- D、 反应中只有部分分子发生有效碰撞
乙苯(  —
—  )与Cl2在光照条件下发生一氯取代反应,基本历程如下图:
)与Cl2在光照条件下发生一氯取代反应,基本历程如下图:  ∙
∙

已知:中间体稳定性:(A)>(B);产物(C)、(D)物质的量之比为14.5∶1。
下列说法错误的是( )
- A、 反应④⑤⑥的△H均小于0
- B、 产生等量的(A)和(B)时,反应③需要消耗更多的能量
- C、 每产生1mol(D),总共消耗氯气7.75mol
- D、 光照条件下,氯原子更容易取代含H较少的碳原子上的H
氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3)。已知部分化学键的键能和化学反应的能量变化如表和图所示。下列说法中正确的是( )
| 化学键 | N—H | N—Cl | H—Cl |
| 键能(kJ/mol) | 391.3 | x | 431.8 |

- A、 表中的x=191.2
- B、 反应过程中的△H2=1405.6kJ·mol-1
- C、 选用合适的催化剂,可降低反应过程中的H值
- D、 NH3(g)+2Cl2(g)=NHCl2(g)+2HCl(g)△H= -22.6kJ·mol-1
已知:295K时,相关物质的相对能量如下表。下列说法错误的是( )
| 物质 | | | | | | | | | |
| 相对能量(kJ/mol) | 52 | 0 | 0 | 0 | -84 | -110 | -393 | -242 | -286 |
- A、 由表中数据,
的标准燃烧热为
- B、
- C、
和
的键能之和大于
的键能
- D、 将碳先转化为水煤气再燃烧与直接燃烧等量的碳,两个过程的热效应是一样的
叔丁基溴能发生乙醇解反应,共分三步进行,其反应进程中的能量变化如图所示,下列说法错误的是( )

- A、 叔丁基溴在乙醇中溶剂解的总反应速率由第三步反应决定
- B、 叔丁基溴在乙醇中溶剂解的总反应属于取代反应
- C、 若叔丁基氯在乙醇中发生相似的溶剂解,则第一步反应的焓变
将增大
- D、 适当升温,叔丁基溴在乙醇中溶剂解正反应速率的增大程度小于其逆反应速率的增大程度
如图为某反应分别在有和没有催化剂条件下的能量变化示意图,下列说法错误的是( )

- A、 反应过程 b 有催化剂参与
- B、 该反应为放热反应,热效应等于 ΔH
- C、 有催化剂条件下,反应的活化能等于E1+E2
- D、 反应过程 a 需要外界供给能量才能持续进行
依据图示关系,下列说法错误的是( )

- A、
- B、 石墨的稳定性比金刚石高
- C、 C(石墨,s)
- D、 1mol石墨或1molCO分别完全燃烧,石墨放出热量多
中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]能利用太阳光实现高效分解水,其原理如图所示。下列叙述错误的是( )

- A、 该催化反应实现了太阳能向化学能的转化
- B、 该催化剂降低了过程Ⅰ和过程Ⅱ反应的△H
- C、 过程I中H2O既是氧化剂又是还原剂,过程Ⅱ中H2O是还原产物
- D、 过程I中生成物H2O2与H2的物质的量之比为1:1
下列说法正确的是( )
- A、 体系的内能与温度等有关,只要温度不变,体系的内能不变
- B、 反应
能自发进行,它的
,
- C、 室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后,所得溶液的pH大于7
- D、 水与丙酮能完全互溶的原因是两种分子间能形成氢键








