选择题
反应  可用于纯硅的制备。下列有关该反应的说法正确的是( )
可用于纯硅的制备。下列有关该反应的说法正确的是( )
- A、 该反应
、
- B、 该反应的平衡常数
- C、 高温下反应每生成1 mol Si需消耗
- D、 用E表示键能,该反应
工业上用 和
和 合成甲醇涉及以下反应:
合成甲醇涉及以下反应:
I.

I.
II.
在催化剂作用下,将和
的混合气体充入一恒容密闭容器中进行反应,达到平衡时,
的转化率和容器中混合气体的平均相对分子质量随温度变化如图。下列判断合理的是

已知:平衡时甲醇的选择性为生成甲醇消耗的在
总消耗量中占比。
- A、
,
- B、 250℃前以反应Ⅱ为主
- C、
, 平衡时甲醇的选择性为60%
- D、 为同时提高
的平衡转化率和平衡时甲醇的选择性,应选择的反应条件为高温、高压
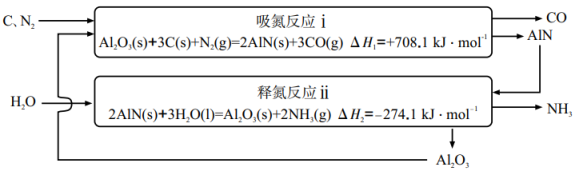
某催化固氮机理如图所示。下列说法正确的是

- A、 固氮过程是将气态含氮物质转化为固态含氮物质
- B、 整个过程中涉及到非极性键的断裂和形成
- C、 三步反应均为氧化还原反应
- D、 步骤Ⅲ可能为ΔH>0,ΔS<0的反应
氢还原辉钼矿并用碳酸钠作固硫剂的原理为MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。平衡时的有关变化曲线如图。下列说法正确的是
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。平衡时的有关变化曲线如图。下列说法正确的是

- A、 该反应在低温下可以自发进行
- B、 粉碎矿物和增大压强都有利于辉钼矿的还原
- C、 图2中T1对应图1中的温度为1300℃
- D、 若图1中A点对应温度下体系压强为10MPa,则H2O(g)的分压为5MPa
反应2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH<0可用于处理汽车尾气。下列说法正确的是
- A、 该反应在任何温度下都能自发进行
- B、 上述反应平衡常数K=
- C、 其他条件相同,增大体系压强,能提高NO的平衡转化率
- D、 其他条件相同,提高c(CO),正反应速率加快,逆反应速率减慢
化学热泵技术作为一种高效环保的节能新技术一直以来广受关注,氨基甲酸铵可应用于化学热泵循环。将一定量纯净的氨基甲酸铵( )粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
)粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强( | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度( | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列说法正确的是( )
- A、 该反应的
, 该反应在较低温度下能自发进行
- B、 25℃时平衡常数的值
- C、 当密闭容器中二氧化碳的体积分数不变时说明该反应达到化学平衡状态
- D、 再加入少量
平衡正向移动
H2S和CO2反应生成的羰基硫(COS)用于粮食熏蒸,能防止某些昆虫、线虫和真菌的危害。CO2(g)+H2S(g)  COS(g)+H2O(g) △H>0,下列说法正确的是
COS(g)+H2O(g) △H>0,下列说法正确的是
- A、 已知该反应在加热条件下能自发进行,则其△S>0
- B、 上述反应的平衡常数K=
- C、 上述反应中消耗1 mol H2S,生成22.4 L水蒸气
- D、 实际应用中,通过增加H2S的量来提高CO2转化率,能有效减少碳排放
一定温度下,在密闭容器中发生反应: 。下列说法正确的是
。下列说法正确的是
- A、 在恒容条件下,向平衡体系中充入惰性气体,平衡不移动
- B、 在恒压条件下,向平衡体系中加入
,
的转化率不变
- C、 混合气体的物质的量不再发生变化可说明反应达到平衡
- D、 该反应在任何温度下都能自发进行
相同温度和压强下,关于物质熵的大小比较,不合理的是
- A、 31g白磷(s)< 31g红磷(s)
- B、 1 molH2(g) < 2 molH2(g)
- C、 1mol H2O(s)< 1molH2O(l)
- D、 1molH2S(g) > 1molH2O(g)
下列关于物质熵的大小比较合理的是( )
- A、 相同压强下,1molH2O(50℃)>1molH2O(80℃)
- B、 相同温度和压强下,1molCO2(g)<2molCO(g)
- C、 标准状况下,1molSO2<1molSO3
- D、 相同条件下,1mol单晶硅>1mol二氧化硅晶体
相同温度和压强下,关于物质熵的大小比较合理的是( )
- A、
- B、
- C、 1molP(s,白磷)>1molP(s,红磷)
- D、
假定 与
与 都是理想气体(气体本身不占体积,不考虑气体间相互作用,不考虑碰撞能量损失),在如图所示的过程中,下列说法正确的是( )
都是理想气体(气体本身不占体积,不考虑气体间相互作用,不考虑碰撞能量损失),在如图所示的过程中,下列说法正确的是( )

- A、 若
、
均为
, 则
, 混合过程自发进行
- B、 若
、
均为
, 则
, 混合过程不自发
- C、 若
、
分别为
与
, 则
, 混合过程自发进行
- D、 若
、
分别为
与
, 则
, 混合过程不自发
下列说法正确的是( )
- A、 常温下,
的熵小于
- B、 自发反应,
, 则
- C、 可以把
分解:
, 收集碳,实现变废为宝
- D、
溶于水,
,
SO2、NOx是重要化工原料,可用于硫酸、硝酸的生产。工业制硫酸时,接触室中主要反应为:2SO2(g)+O2(g) =2SO3(g) ΔH=-196.6 kJ·mol-1 , SO2、NOx也是大气主要污染物,NOx可与NH3混合,通过选择性催化剂高温脱除,SO2可通过碱液吸收去除。对于反应 2SO2(g)+O2(g)  2SO3(g),下列说法正确的是( )
2SO3(g),下列说法正确的是( )
- A、 该反应ΔH<0 ΔS>0
- B、 2 mol SO2(g)和1 mol O2(g)所含键能总和比2 mol SO3(g)所含键能小
- C、 反应在高温、催化剂条件下进行可提高SO2的平衡转化率
- D、 该反应中每生成22.4 L SO3转移电子的数目约等于2×6.02×1023
C、Si同处于IVA族,它们的单质或化合物有重要用途。实验室可用CO2回收废液中的苯酚,工业上用SiO2和焦炭高温下反应制得粗硅,再经如下2步反应制得精硅:Si(s)+3HCl(g)= SiHCl3(g)+H2(g) △H= -141.8 kJ·mol-1 , SiHCl3(g)+ H2(g)= Si(s)+3HCl(g),反应过程中可能会生成SiCl4。有关反应Si(s)+3HCl(g)  SiHCl3(g)+H2(g)的说法正确的是( )
SiHCl3(g)+H2(g)的说法正确的是( )

- A、 该反应的△H<0,△S>0
- B、 其他条件不变,增大压强SiHCl3平衡产率减小
- C、 实际工业生产选择高温,原因是高温时Si的平衡转化率比低温时大
- D、 如图所示,当
>3,SiHCl3平衡产率减小说明发生了副反应
以NaCl为原料,可制取Na、Na2O2、NaOH和Na2CO3等。Na2CO3 , 可用侯氏制碱法制取,主要涉及如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
对于反应N2(g)+3H2(g) 2NH3(g),下列说法正确的是( )
- A、 该反应的ΔS>0
- B、 该反应的平衡常数可表示为
- C、 其他条件相同,增大
,H2转化率减小
- D、 使用催化剂能降低该反应的焓变
N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法错误的是( )


- A、 总反应为N2O(g)+CO(g)=CO2(g)+N2(g) ΔH=ΔH1+ΔH2
- B、 为了实现转化,需不断向反应器中补充Pt2O+和Pt2O
- C、 该反应正反应的活化能小于逆反应的活化能
- D、 总反应的ΔH=-226 kJ·mol-1
关于①氨气与氯化氢气体的反应、②碳酸氢钠的分解反应的熵变说法正确的是( )
- A、 均为熵增加反应
- B、 均为熵减小反应
- C、 反应①熵增加,反应②熵减小
- D、 反应①熵减小,反应②熵增加
相同的温度和压强下,有关下列两个反应的说法错误的是
反应 | △H/kJ•mol-1 | △n | △S/J•K•mol-1 |
MgCO3(s)=MgO(s)+CO2(g) | 117.6 | 1 | a |
CaCO3(s)=CaO(s)+CO2(g) | 177.9 | 1 | b |
注:①其中△n表示反应方程式中气体系数差;
②△H-T△S<0的反应方向自发
- A、 因为△n相同,所以a与b大小相近
- B、 热分解温度:MgCO3(s)>CaCO3(s)
- C、 a-b=S[MgO(s)]+S[CaCO3(s)]-S[MgCO3(s)]-S[CaO(s)]
- D、 两个反应在不同温度下的△H和△S都大于零
下列说法正确的是( )
- A、 从
(g)→
(l)→
(s),熵依次增加
- B、 可逆反应都有一定的限度,限度越大反应物的转化率一定越高
- C、 可逆反应,若总键能:反应物>生成物,则升高温度不利于提高反应物的转化率
- D、 对于气体反应,其他条件不变,增大压强反应速率加快,与活化分子的百分含量无关
Cl2可用于生产漂白粉等化工产品。Cl2的制备方法有:
方法ⅠNaClO+2HCl(浓)=NaCl+Cl2↑+H2O;
方法Ⅱ4HCl(g)+O2(g)=2H2O(g)+2Cl2(g)ΔH=akJ·mol−1
上述两种方法涉及的反应在一定条件下均能自发进行。一定条件下,在密闭容器中利用方法Ⅱ制备Cl2 , 下列有关说法正确的是( )
- A、 升高温度,可以提高HCl的平衡转化率
- B、 提高
,该反应的平衡常数增大
- C、 若断开1molH-Cl键的同时有1molH-O键断开,则表明该反应达到平衡状态
- D、 该反应的平衡常数表达式K=