选择题
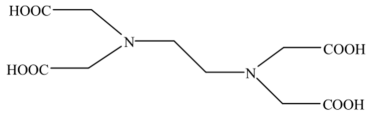
一种可吸附甲醇的材料,其化学式为 , 部分晶体结构如下图所示,其中
, 部分晶体结构如下图所示,其中 为平面结构。
为平面结构。
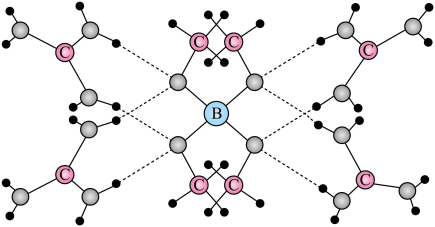
下列说法正确的是
- A、 该晶体中存在N-H…O氢键
- B、 基态原子的第一电离能:
- C、 基态原子未成对电子数:
- D、 晶体中B、N和O原子轨道的杂化类型相同
X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的 轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法错误的是
轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法错误的是
- A、 电负性:
- B、 最高正价:
- C、 Q与M的化合物中可能含有非极性共价键
- D、 最高价氧化物对应水化物的酸性:
工业上电解熔融 和冰晶石
和冰晶石 的混合物可制得铝。下列说法正确的是( )
的混合物可制得铝。下列说法正确的是( )
- A、 半径大小:
- B、 电负性大小:
- C、 电离能大小:
- D、 碱性强弱:
联氨(N2H4)为二元弱碱,在水中的电离方式与氨相似,可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列说法正确的是

- A、 结合H+能力:NH3>N2H4
- B、 H-N-H键角:NH3>[Cu(NH3)4]2+
- C、 第一电离能:O>N>Cu
- D、 中心离子半径:[Cu(NH3)4]2+>[Cu(NH3)2]+
生物大分子血红蛋白分子链的部分结构及载氧示意如图, 与周围的6个原子均以配位键结合。
与周围的6个原子均以配位键结合。 也可与血红蛋白配位,使人体中毒。二者与血红蛋白
也可与血红蛋白配位,使人体中毒。二者与血红蛋白 结合的反应可表示为:①
结合的反应可表示为:① ;②
;② 。下列说法错误的是
。下列说法错误的是

- A、 构成血红蛋白分子链的多肽链之间存在氢键
- B、 电负性:C>O,故
中与
配位的是C
- C、
与血红素中
结合能力强于
- D、
中毒患者进入高压氧舱治疗,平衡①、②移动的方向相反
已知X、Y、Z、W是短周期元素。X元素原子的 能级处于半充满状态;Y元素原子L电子层上s电子数和p电子数相等;Z元素的
能级处于半充满状态;Y元素原子L电子层上s电子数和p电子数相等;Z元素的 价阳离子的核外电子排布与氖原子相同;W元素原子的M电子层有1个未成对的p电子。下列说法正确的是( )
价阳离子的核外电子排布与氖原子相同;W元素原子的M电子层有1个未成对的p电子。下列说法正确的是( )
- A、 含有Y元素的化合物一定是共价化合物
- B、 电负性:Y>X
- C、 Z元素的第一电离能大于同周期其他元素
- D、 若W为金属元素,则其单质能与
溶液反应放出氢气
近年来,光催化剂的研究是材料领域的热点方向。一种Ru配合物(如图所示)复合光催化剂可将 转化为HCOOH。下列说法错误的是( )
转化为HCOOH。下列说法错误的是( )

- A、 Ru配合物中第二周期元素的电负性由大到小的顺序为O>N>C
- B、 如图结构的吡啶环(
 )中
)中 - C、 N原子的杂化方式分别为
、
C.该配合物中Ru的配位数是6
- D、 HCOOH的沸点比
高,主要原因是HCOOH分子间存在范德华力和氢键,而
分子间只有范德华力
下列反应产物不能用反应物中键的极性解释的是
- A、
 +HCN→
+HCN→
- B、
 +NH3
+NH3 +HCl
+HCl - C、 CH3CH2OH+HBr
CH3CH2Br+H2O
- D、 CH3CH=CH2+H2
CH3CH2CH3
某种天然沸石的化学式为 , 其中元素X、Y、Z、R、W原子序数依次增大,且占据四个不同周期。Y在地壳中含量最高,在该化合物中R显示其最高价态,基态W原子的核外电子恰好填满10个原子轨道。下列说法错误的是
, 其中元素X、Y、Z、R、W原子序数依次增大,且占据四个不同周期。Y在地壳中含量最高,在该化合物中R显示其最高价态,基态W原子的核外电子恰好填满10个原子轨道。下列说法错误的是
- A、 简单离子半径:
- B、 第一电离能:
- C、 最简单氢化物稳定性:
- D、 氯化物熔点:
钴(Co)在化学上称为铁系元素,其化合物在生产生活中应用广泛。以甲醇为溶剂,Co2+可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示),下列说法错误的是

- A、 色胺酮分子中所含元素第一电离能由大到小的顺序为N>O>H>C
- B、 色胺酮分子中N原子均为sp3杂化
- C、 色胺酮钴配合物中钴的配位数为4
- D、 X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过氢键作用与色胺酮钴配合物相结合
某离子液体结构如图,其中Q、R、T、X、Y和Z为原子序数依次增大的主族元素,基态T原子和Y原子的最外层均有两个单电子,Q、R、X和Z的质子数均为奇数且之和为22。下列说法错误的是

- A、 电负性:Q<T<R
- B、 最高价氧化物对应水化物的酸性:R <T
- C、
的空间结构为正四面体形
- D、 T形成的单质可能为共价晶体、分子晶体或混合型晶体
硅及其化合物广泛应用于光电材料领域,其中SiCl4与N-甲基咪唑( )反应可以得到M2+ , 其结构如图所示。下列叙述错误的是
)反应可以得到M2+ , 其结构如图所示。下列叙述错误的是

- A、 SiCl4的空间构型为正四面体
- B、 1个M2+中含有42个σ键。
- C、 H、C、N的电负性由大到小的顺序为N>C>H
- D、 N-甲基咪唑分子中碳原子的杂化轨道类型为sp2、sp3
周期表前四周期的元素X、Y、Z、Q、R,原子序数依次增大。X的核外电子总数与其周期数相同,Y的价层电子中的未成对电子有3个,Z的最外层电子数为其内层电子数的3倍,Q与Z同族,R的最外层只有1个电子,内层全充满。下列判断正确的是
- A、 简单氢化物的热稳定性;Z>Y>Q
- B、 非金属元素电负性由大到小的顺序;Z>Q>Y>X
- C、 X和Y形成的化合物中均为极性键
- D、 R为金属元素,属于s区