选择题
- A、
中含有的电子数为1.3
- B、
中含有的共价键的数目为0.1
- C、
肼
含有的孤电子对数为0.2
- D、
,生成
乙烷时断裂的共价键总数为
设  为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
- A、
含有
键的数目为
- B、
的盐酸含有阴离子总数为
- C、
与
混合后的分子数目为
- D、
与足量
反应生成的
分子数目为
绿矾( )分解可制备铁红,同时产生
)分解可制备铁红,同时产生 、
、 和
和 。设NA为阿伏加德罗常数的值,下列说法错误的是
。设NA为阿伏加德罗常数的值,下列说法错误的是
- A、
溶液含有的阳离子数大于NA
- B、 0.5mol三聚
分子(
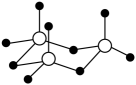 )中含有σ键数目为6 NA
)中含有σ键数目为6 NA - C、 绿矾分解生成16g
时,转移电子数为0.2 NA
- D、 22.4L
溶于水,溶液中
、
、
的数目总和为NA
设NA表示阿伏加德罗常数的值,下列叙述中正确的是
- A、 含4.8g碳元素的石墨晶体中的共价键数是0.8NA
- B、 标准状况下,甲烷和氧气的混合气体共22.4L,完全燃烧后产物的分子总数可能为NA
- C、 10g的D2O中含有的质子数与中子数分别为5NA和4NA
- D、 常压、500℃、催化条件下,1molSO2和0.5molO2充入一密闭容器内,充分反应后的生成物分子数为NA
2021年9月,中国科学院天津工业生物技术研究所在实验室首次颠覆性地实现了从二氧化碳到淀粉分子的全合成,这是中国科学家在人工合成淀粉方面取得的原创性突破。下列有关说法中错误的是( )

- A、 反应①中二氧化碳被还原,氧化剂和还原剂的物质的量之比为3:1
- B、 该技术要得以推广,所需的大量氢气可以来自光伏电解X
- C、 反应②涉及极性键与非极性键的断裂和生成
- D、 该技术的开发实现了无机物向有机物的转化,对缓解粮食危机具有重大意义
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
- A、 0.1mol·L-1 AlCl3溶液含Cl- 为0.3NA
- B、 92g NO2和92g N2O4都含有4NA个氧原子
- C、 标准状况下,22.4L CCl4中共价键数目为4NA
- D、 0.1mol氯气通入足量FeBr2溶液中,被氧化的Br-数为0.2NA
某实验室开发了如图所示的一种电解装置,可实现电解海水制氢气,同时处理含 的碱性工业废水,使
的碱性工业废水,使 在电极上直接放电实现产物无害化。下列说法正确的是( )
在电极上直接放电实现产物无害化。下列说法正确的是( )

- A、
中,
键和
键数目之比为5∶1
- B、 NiCo@C电极处理
时发生的反应为:
- C、 离子交换膜应选用阴离子交换膜
- D、 该电解池工作时,阴极附近溶液的pH逐渐增大
化合物 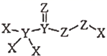 是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是( )
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是( )
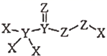 是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是( )
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是( )- A、 原子半径:Z>Y>X
- B、 Z的第一电离能比同周期相邻元素都大
- C、 1mol该化合物分子中含有的非极性键数目为2NA
- D、 该化合物中X、Y、Z都满足8电子稳定结构
用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
- A、 0.1 mol苯乙烯中碳碳双键的数目为0.1NA
- B、 常温下,46 g由NO2和甲硫醛( H2CS)组成的混合物中含有的分子数为NA
- C、 标准状况下,2.24 LNH3中含有的共价键数目为0.3NA
- D、 100 mL0.1 mol/LNa3AsO4溶液中阴离子总数大于0.01NA
已知NA为阿伏加德罗常数的值。下列说法正确的是( )
- A、 1molNH4F晶体中含有共价键数目为4NA
- B、 1L0.1mol/L磷酸钠溶液含有的
数目与0.1L1mol/L磷酸钠溶液含有的
数目相等
- C、 标况下,3.36LHF中含有的质子数为1.5NA
- D、 60gSiO2晶体中含有的Si-O键数目为2NA
设NA为阿伏加德罗常数的值。下列说法正确的是( )
- A、 7.8g苯中含碳碳双键的数目为3NA
- B、 16.25gFeCl3水解形成的氢氧化铁胶体粒子数为0.1NA
- C、 1molCH4与1molCl2在光照下充分反应,生成CH3Cl的分子数为NA
- D、 3g3He含有的中子数为NA
设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
- A、 14g乙烯和环丙烷的混合物中含C-H键数目为2NA
- B、 标准状况下,2.24L环己烷的分子数为0.1NA
- C、 常温常压下,1mol氨基(-NH2)含有的电子数为10NA
- D、 36g由35Cl和37Cl组成的氯气中所含质子数一定为17NA
设NA表示阿伏加德罗常数的值。下列叙述错误的是( )
- A、 标准状况下,1 mol Fe在22.4 L Cl2中完全燃烧时转移电子数为3NA
- B、 6.5gNaN3中含有的阴离子数目为0.1NA
- C、 常温下,0.1 mol环丙烷中含有的共价键数为0.9NA
- D、 1 L 0.1 mol·L-1 Na2S溶液中S2-数目与HS-数目之和小于0.1NA
设NA为阿伏加德罗常数的值,下列说法正确的是( )
- A、 标准状况下,22.4LSO3中含有的分子数约为1NA
- B、 1mol白磷P4固体所含共价键数目为4NA
- C、 78gNa2O2晶体所含离子的微粒数为3NA
- D、 常温常压下,22.4L氯气溶于水,转移电子数为1NA
NA是阿伏加德罗常数的值。下列说法正确的是( )
- A、 32gO2中所含的质子数为32NA
- B、 25℃时,pH=12的NaOH溶液中OH-数目为0.01NA
- C、 100g3.4%的H2O2溶液中所含的极性键数目为0.2NA
- D、 标准状况下,H2和CO的混合气体22.4L完全燃烧,转移的电子数为2NA
设NA为阿伏加德罗常数的值,下列说法正确的是( )
- A、 30gC2H6中含有极性共价键的数目为7NA
- B、 标准状况下,11.2LHF中含有质子的数目为5NA
- C、 5.6gFe与足量稀硝酸反应,转移电子的数目为0.2NA
- D、 7.8gNa2S和Na2O2的混合物中,含有阴离子的数目为0.1NA
设NA为阿伏加德罗常数的值。下列说法正确的是( )
- A、 1mol乙醇分子中含C—H键的数目为6NA
- B、 标准状况下,22.4L的12C18O中含有中子的数目为16NA
- C、 密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加了2NA个P—Cl键
- D、 常温下,1L0.1mol·L-1的醋酸溶液中H+数目为0.1NA
NA为阿伏加德罗常数的值。下列说法错误的是( )
- A、 常温常压下,3.2g N2H4所含共价键的数目为 0.5NA
- B、 7g乙烯与7g环丙烷组成的混合物中所含氢原子数为2 NA
- C、 0.5mol SO2与足量O2在适宜条件下充分反应转移电子数小于NA
- D、 1L0.1mol/L的NaHSO3溶液中HSO
和SO
的粒子数之和为0.1NA
NA是阿伏加德罗常数的值,下列说法正确的是( )
- A、 20gD216O含中子数目为9NA
- B、 1molN2H4含极性键数目为4NA
- C、 50mL2mol/LCH3COONa溶液中,阴离子的数目小于0.1NA
- D、 2.24LCl2与足量NaOH溶液反应,转移电子的数目为0.2NA
NA为阿伏加德罗常数的值。下列叙述正确的是( )
- A、 标准状况下,2.24LHCl气体中H+数目为0.1NA
- B、 标准状况下,2.24LD2中所含中子数目为0.4NA
- C、 常温常压下,6.2gP4中所含P-P键数目为0.3NA
- D、 0.2molSO2和0.1molO2在密闭容器中充分反应后的分子总数为0.2NA
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
- A、 14 g聚丙烯中含C-H键总数目为NA
- B、 氢氧燃料电池正极消耗22. 4 L(标准状况)气体时,电路中通过的电子数目为2NA
- C、 2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0. 2NA之间
- D、 电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA
NA是阿伏加德罗常数的值。下列说法正确的是( )
- A、 1 mol SiO2中含有2 mol硅氧键
- B、 1 mol T2O比1 mol H2O多4 NA个中子
- C、 1 L 0.1 mol/LNa2CO3溶液中含有的阴离子的总数为0.1 NA
- D、 标准状况下,1 mol O2和O3的混合物中有5NA个氧原子
NA是阿伏加德罗常数的值。下列说法正确的是( )
- A、 标准状况下,2.24L四氯化碳含共价键总数为0.4NA
- B、 由H218O与D216O组成的4.0g混合物含中子数为2NA
- C、 由NO2与N2O4组成的4.6g混合气体含氮原子数为0.5NA
- D、 标准状况下,溶有6.72LSO2的水中HSO
与SO
的微粒数目之和为0.3NA
NA为阿伏加德罗常数的值,下列说法正确的是( )
- A、 12g
C所含的原子数为阿伏加德罗常数
- B、 O2的相对分子质量为32,所以O2的摩尔质量也为32。
- C、 标准状况下,1molNO 与11.2L O2充分反应后分子总数为NA
- D、 P4为正四面体形分子,则1 mol P4分子中含有6NA个共价键
设NA为阿伏加德罗常数的值,下列说法错误的是( )
- A、 34gH2O2中含有18NA个中子
- B、 1L0.1mol·L-1NH4Cl溶液中,阴离子数大于0.1NA
- C、 标准状况下,22.4LCH4和C2H4的混合气体中含有C—H键的数目为4NA
- D、 足量Fe与1molCl2完全反应,转移的电子数目为2NA
设阿伏加德罗常数的值为  。下列说法正确的是( )
。下列说法正确的是( )
- A、 17g羟基(-OH)所含电子总数为
- B、 标准状况下,1.12L苯含有
键的个数为
- C、
和足量
反应,产生的气体的分子数为
- D、 0.5mol乙酸乙酯在酸性条件下水解,生成乙醇的分子数为
肼  是火箭常用的高能燃料,其球棍模型如图所示。肼能与双氧水发生反应:
是火箭常用的高能燃料,其球棍模型如图所示。肼能与双氧水发生反应:  。用
。用  表示阿伏加德罗常数的值,下列说法中正确的是( )
表示阿伏加德罗常数的值,下列说法中正确的是( )

- A、 标准状况下,
中所含电子总数为
- B、 标准状况下,
中所含原子总数为
- C、 标准状况下,
中含有共价键的总数为
- D、 若生成
,则上述反应转移电子的数目为
用NA代表阿伏加德罗常数的数值。下列说法正确的是( )
- A、 4 6 gC2H6O中含有碳氢共价键的数目为0.5 NA
- B、 1.8g H2O和D2O混合物中含有的中子数为0.8NA
- C、 MnO2与浓盐酸反应产生22.4LCl2(标准状况)时转移电子数为2NA
- D、 1LpH=1的CH3COOH溶液中CH3COO-、CH3COOH数目之和为0.1 NA
设NA为阿伏加德罗常数的值。下列说法正确的是( )
- A、 标准状况下,11.2 L苯中所含C—H键数目为3NA
- B、 7.8 g Na2S和Na2O2组成的混合物,所含阴离子总数为0.1NA
- C、 1 mol Cl2发生反应时,转移的电子数一定为2NA
- D、 常温下,pH=2的H2SO4溶液中所含H+数目为0.01NA
设  为阿伏加德罗常数的值。捕获
为阿伏加德罗常数的值。捕获  生成甲酸的过程如图所示。下列说法错误的是( )
生成甲酸的过程如图所示。下列说法错误的是( )

- A、
中所含的共价键数目为
- B、 标准状况下,
中所含的质子数目为
- C、
乙基所含的电子总数为
- D、
的甲酸水溶液中所含的氧原子数目为
- A、 将0.1
溶于足量水,转移的电子总数为0.1
- B、 常温常压下,36g
中所含的中子数为18
- C、 2.24L(标准状况)乙烯被溴的四氯化碳溶液完全吸收,断裂的共价键总数为0.1
- D、 7.8g
与
的混合物中,离子总数为0.3
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
- A、 60gSiO2晶体中含有的Si—O键数目为2NA
- B、 pH=1的H3PO4溶液中所含H+的数目为0.1NA
- C、 用含0.1molFeCl3的饱和溶液制备Fe(OH)3胶体,所得胶体粒子数目最多为0.1NA
- D、 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,Na失去NA个电子