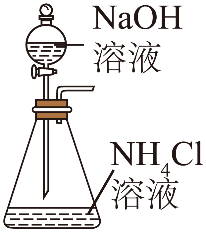
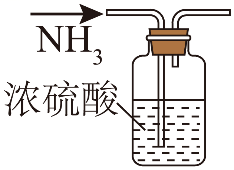
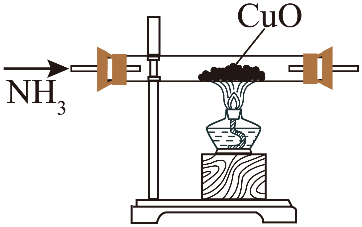
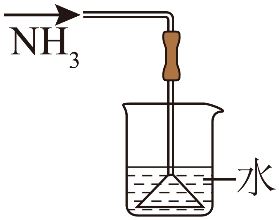
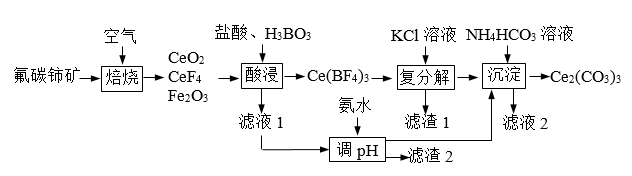
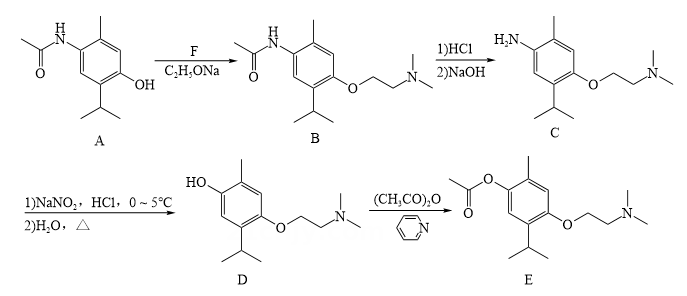
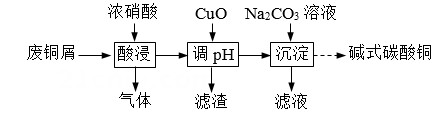
单选题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项符合题意。
2023年9月23日,第19届杭州亚运会开幕式首次使用废碳再生的绿色甲醇作为主火炬塔燃料,实现循环内二氧化碳零排放。该措施最积极的意义在于( )
- A、 有利于实现碳中和
- B、 有利于降低火炬燃料成本
- C、 有利于燃料充分燃烧
- D、 使开幕式点火场面更壮观
H2O2是一种绿色氧化剂,可通过反应Na2O2 + H2SO4 + 10H2O = Na2SO4·10H2O + H2O2制取。下列说法正确的是( )
- A、 Na的结构示意图为
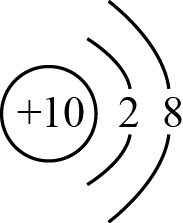
- B、 Na2O2既含离子键又含共价键
- C、 H2O2的电子式为

- D、 H2O属于非电解质
二氯异氰尿酸钠(结构如右图所示)是一种重要的消毒剂。下列说法正确的是( )
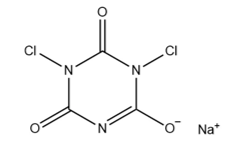
- A、 电负性:χ(N) > χ(O)
- B、 键极性:C-N > C-O
- C、 第一电离能:I1(C) > I1(N)
- D、 离子半径:r(O2-) > r(Na+)
已知2NO2(g) + NaCl(s) NaNO3(s) + ClNO(g)
NaNO3(s) + ClNO(g)  , 下列说法正确的是( )
, 下列说法正确的是( )
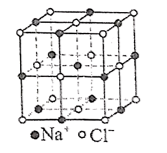
- A、 该反应的平衡常数
- B、 该反应一定能自发进行
- C、 该反应中每消耗1molNO2 , 转移电子的数目约为3.01×1023
- D、 NaCl晶胞(如图所示)中每个Na+周围与其距离最近的Na+有6个
3-丙基-5,6-二羟基异香豆素(Y)的一步合成路线反应如图。下列有关说法正确的是( )
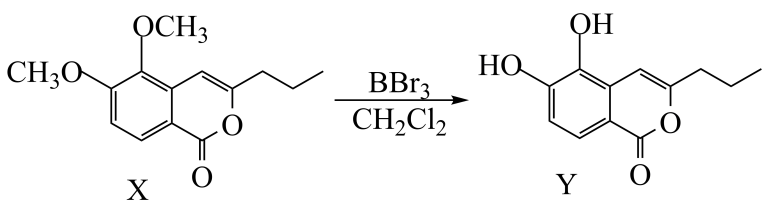
- A、 X中所有碳原子不可能共平面
- B、 Y与足量H2加成后有5个手性碳原子
- C、 1molY最多能与4molNaOH反应
- D、 1molY与浓溴水反应,最多消耗2molBr2
科研人员通过控制光沉积的方法构建Cu2O-Pt/SiC/LrOx型复合材料光催化剂,然后以Fe2+和Fe3+离子渗透Nafion膜在酸性介质下构建了一个还原和氧化反应分离的人工光合体系,其反应机理如图。下列说法不正确的是( )
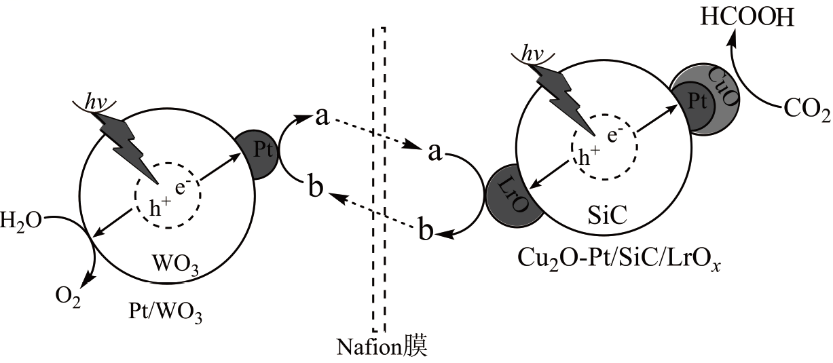
- A、 该反应能量转化形式为光能→化学能
- B、 该人工光合体系的总反应为2CO2+2H2O
2HCOOH+O2
- C、 图中a、b分别代表Fe3+、Fe2+
- D、 Cu2O-Pt上发生的反应为CO2 + 2e- + 2H+ = HCOOH
一种利用K2CO3捕集水煤气中CO2的工艺如图所示。[已知该温度下Ka1(H2CO3) = 4.6×10-7 , Ka2(H2CO3) = 5.0×10-11]。下列说法正确的是( )
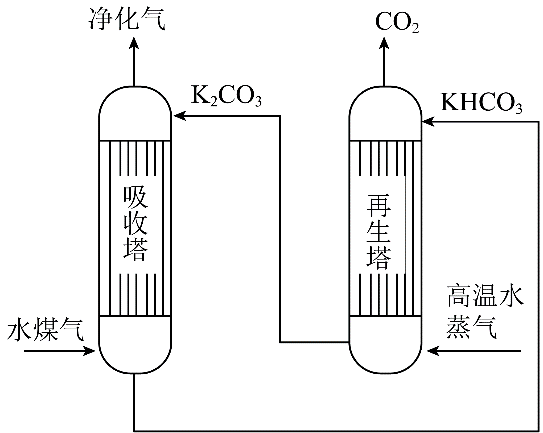
- A、 K2CO3溶液中:2c(K+) = c(CO32-) + c(HCO3-) + c(H2CO3)
- B、 吸收塔中c(CO32-) :c(HCO3-)=1:2时,溶液pH=10
- C、 再生塔所得到的溶液中可能存在:c(H2CO3)>c(HCO3-)
- D、 再生塔中发生反应的化学方程式:KHCO3 + KOH = K2CO3 + H2O + CO2↑
一定条件下,将一定量的CO2和H2混合气体通过装有催化剂的反应器可得到甲烷。
已知:Ⅰ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41 kJ·mol-l
Ⅱ.CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-165 kJ·mol-1
在两种不同催化剂作用下反应相同时间,CO2转化率和生成CH4选择性随温度变化关
系如图所示(CH4选择性=×100%)。
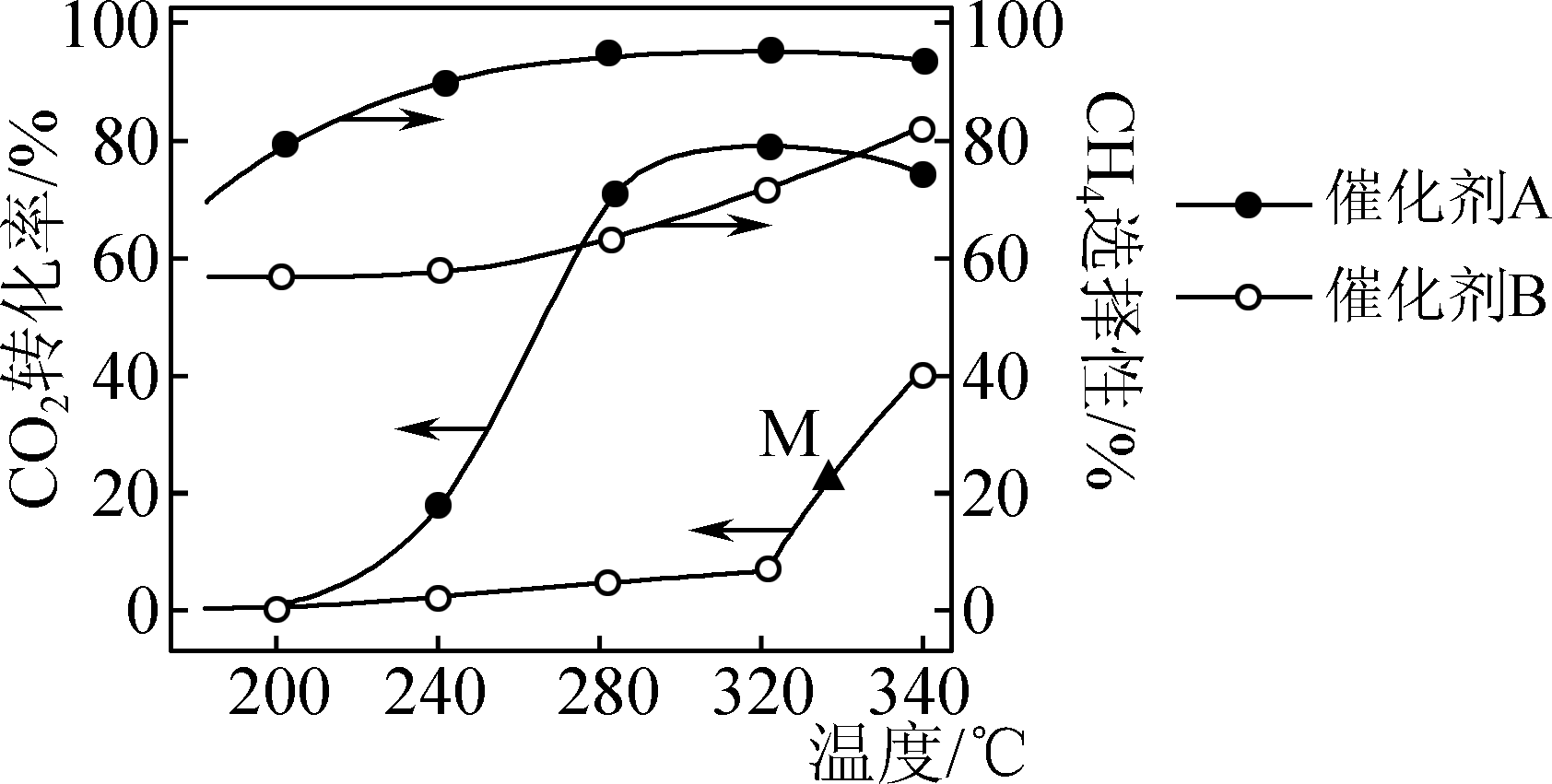
下列说法不正确的是( )
- A、 反应CO(g)+3H2(g)=CH4(g)+H2O(g)的ΔH=-206 kJ·mol-1
- B、 在280 ℃条件下反应制取CH4 , 选择催化剂A的效果较好
- C、 260~300 ℃间,使用催化剂A或B,升高温度时CH4的产率都增大
- D、 M点可能是该温度下的平衡点,延长反应时间,不一定能提高CH4的产率