单项选择题
在2L的密闭容器中,发生以下反应:2A(g)+B(g)⇌2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速率为0.12mol/(L•s),则10s时,容器中B的物质的量是( )
- A、 3.4 mol
- B、 3.2 mol
- C、 2.8 mol
- D、 1.2 mol
对于可逆反应N2(g)+3H2(g)⇌2NH3(g),下列措施能使反应物中活化分子百分数和化学平衡常数都变化的是( )
- A、 增大压强
- B、 充入更多N2
- C、 使用高效催化剂
- D、 降低温度
对可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列叙述正确的是( )
- A、 达到化学平衡时,4υ正(O2)=5υ逆(NO)
- B、 若单位时间内生成x mol NO的同时,消耗x mol NH3 , 则反应达到平衡状态
- C、 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
- D、 化学反应速率关系是:2υ正(NH3)=3υ正(H2O)
反应CH3OH ( l )+NH3( g )═CH3NH2( g )+H2O ( g )在某温度自发向右进行,若反应|△H|=17kJ/mol,|△H﹣T△S|=17kJ/mol,对于该反应下列关系正确的是( )
- A、 △H>0,△H﹣T△S<0
- B、 △H<0,△H﹣T△S>0
- C、 △H>0,△H﹣T△S>0
- D、 △H<0,△H﹣T△S<0
下列电离方程式正确的是( )
- A、 H2CO3⇌2H++CO32﹣
- B、 NH3•H2O⇌NH4++OH﹣
- C、 Fe(OH)3=Fe3++3OH﹣
- D、 NaHSO4
Na++H++SO42﹣
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)⇌H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
- A、 25%
- B、 50%
- C、 75%
- D、 80%
可逆反应2A(g)+3B(g)⇌4C(g)+D(g),已知起始浓度c(A)=4mol•mol﹣1 , c(B)=3mol•mol﹣1 , C、D浓度均等于0,反应开始2秒后达到平衡状态,此时D的平衡浓度为0.5mol•L﹣1 , 则下列说法不正确的是( )
- A、 反应速率v(C)=1mol•L﹣1•s﹣1
- B、 C的平衡浓度为4 mol•L﹣1
- C、 A的转化率为25%
- D、 B的平衡浓度为1.5 mol•L﹣1
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)⇌2Z(g),一定达到化学平衡状态的是( )
①X,Y,Z的物质的量之比为1:2:2
②X,Y,Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y.
- A、 ①②
- B、 ①④
- C、 ②③
- D、 ③④
利用反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H=﹣746,8kJ•mol﹣1,可净化汽车尾气,如果要同时提高反应的速率和 NO 的转化率,采取的措施是( )
- A、 降低温度
- B、 升高温度同时充入N2
- C、 增大压强
- D、 及时将 CO2和 N2 从反应体系中移走
下列各组比较中,前者比后者大的是( )
- A、 25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度
- B、 25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度
- C、 25℃时,同浓度的NaCl溶液和氨水的导电能力
- D、 25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度
对可逆反应2A(s)+3B(g)⇌C(g)+2D(g)△H<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高.
- A、 ①②
- B、 ④
- C、 ③
- D、 ④⑤
已知下列热化学方程式:(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=﹣870.3kJ/mol;(2)C(s)+O2(g)═CO2(g)△H2=﹣393.5kJ/mol;(3)H2(g)+  O2(g)═H2O(l)△H3=﹣285.8kJ/mol.则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的△H为( )
O2(g)═H2O(l)△H3=﹣285.8kJ/mol.则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的△H为( )
- A、 ﹣488.3 kJ/mol
- B、 ﹣244.15 kJ/mol
- C、 +488.3 kJ/mol
- D、 +244.15 kJ/mol
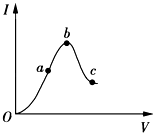
一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)⇌pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )

- A、 正反应是吸热反应
- B、 逆反应是放热反应
- C、 m+n<p+q
- D、 m+n>p+q
符合图1、图2的反应是( )

- A、 X+3Y⇌2Z△H>0
- B、 X+3Y⇌2Z△H<0
- C、 X+2Y⇌3Z△H<0
- D、 5X+3Y⇌4Z△H<0
在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)⇌N2O4(g)△H<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度.
- A、 ①和③
- B、 ③和⑤
- C、 ④和⑤
- D、 ②和④
将C(H+)相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸)分别与锌反应,若最后有一溶液中有锌剩余,且放出的气体一样多,对此有如下判断:
⑴反应所需时间:乙<甲
⑵开始时反应速率:甲>乙
⑶参加反应的锌的质量:甲=乙
⑷整个反应阶段的平均速率:乙>甲
⑸盛盐酸的容器中有锌剩余
⑹盛醋酸的容器中有锌剩余.
以上判断正确的是( )
- A、 (1)(2)(3)(5)
- B、 (1)(3)(5)
- C、 (2)(3)(6)
- D、 (1)(3)(4)(5)
在体积为VL的恒容密闭容器中盛有一定量H2 , 通入Br2(g)发生反应:H2(g)+Br2(g)⇌2HBr(g);△H<0. 当温度分别为T1、T2达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法不正确的是( )

- A、 由图可知:T1>T2
- B、 a、b两点的反应速率:b>a
- C、 为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
- D、 T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )

- A、 往平衡体系中加入金属铅后,c(Pb2+)增大
- B、 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
- C、 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
- D、 25℃时,该反应的平衡常数K=2.2
某温度下,H2(g)+CO2(g)⇌H2O(g)+CO(g)的平衡常数K=  ,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是( )
,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol•L﹣1 | 0.010 | 0.020 | 0.020 |
c(CO2)/mol•L﹣1 | 0.010 | 0.010 | 0.020 |
- A、 平衡时,乙中CO2的转化率大于60%
- B、 平衡时,甲中和丙中H2的转化率均是60%
- C、 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol•L﹣1
- D、 反应开始时,丙中的反应速率最快,甲中的反应速率最慢