选择题
一定温度下,在某容器中进行如下可逆反应,当混合气体的平均摩尔质量不再改变时,说明反应达到平衡状态的是 ( )
①恒容时发生反应:A(g)+B(g)⇌3C(g)
②恒压时发生反应:A(g)+B(g)⇌2C(g)
③恒容时发生反应:A(g)+2B(g)⇌2C(g)+D(g)
④恒压时发生反应:A(g)+2B(g)⇌3C(g)J﹣D(s)
- A、 ②③
- B、 ①④
- C、 ①③
- D、 ②④
下列说法正确的是( )
- A、 增大体系压强,活化分子数增加,化学反应速率一定增大
- B、 加入反应物,使活化分子百分数增加,化学反应速率增大
- C、 活化分子间所发生的分子间的碰撞均为有效碰撞
- D、 升高温度,活化分子百分数增加,化学反应速率一定增大
已知反应①:CO(g)+CuO(s)⇌CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)⇌Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2 , 该温度下反应③:CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )
- A、 反应①的平衡常数K1=
- B、 反应③的平衡常数K=
- C、 对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值
- D、 对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小
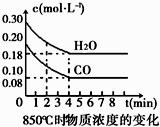
已知NO2和N2O4可以相互转化:2NO2(g)⇌N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
- A、 图中的两条曲线,X表示NO2浓度随时间的变化曲线
- B、 前10 min内用v(N2O4)=0.02 mol/(L•min)
- C、 25 min时,NO2转变为N2O4的反应速率增大,其原 因是将密闭容器的体积缩小为1L
- D、 该温度下反应的平衡常数 K=1.11 L/mol
在372K时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为 0.02mol•L﹣1 . 在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.下列说法正确的是( )
- A、 前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L﹣1•s﹣1
- B、 在2s时体系内压强为开始时的1.1倍
- C、 在平衡时体系内含有N2O40.25 mol
- D、 平衡时,N2O4的转化率为40%
某密闭容器中,A(s)+3 B(g)⇌2 C(g)+D(g)△H>0在一定条件下达到平衡,下列说法正确的是( )
- A、 加入少量A,B的转化率增大
- B、 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
- C、 增大压强,平衡不移动,正、逆反应速率不变
- D、 加入催化剂,反应速率增大,平衡常数不变
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)⇌3Z(g),平衡时,X,Y,Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X,Y,Z的体积分数不变.下列叙述不正确的是( )
- A、 m=2
- B、 两次平衡的平衡常数相同
- C、 X与Y的平衡转化率之比为1:1
- D、 第二次平衡时,Z的浓度为0.4mol•L﹣1
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)+9072kJ/K=1.1×1026
②4NH3(g)+4O2(g)⇌2N2O(g)+6H2O(g)+1105kJ/K=4.4×1028
③4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)+1269kJ/K=7.1×1034
其中,②、③是副反应.若要减少副反应,提高NO的产率,最合理的措施是( )
- A、 减小压强
- B、 降低温度
- C、 增大O2浓度
- D、 使用合适的催化剂
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)⇌  N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
- A、 加催化剂同时升高温度
- B、 加催化剂同时增大压强
- C、 升高温度同时充入N2
- D、 降低温度同时增大压强
一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)⇌Y(g)+Z(s),以下不能作为反应达到平衡标志的是( )
- A、 X的分解速率是Y的消耗速率的2倍
- B、 混合气体的压强不再变化
- C、 单位时间内生成1mol Y的同时分解2 mol X
- D、 混合气体的密度不再变化
一定温度下,在一容积不变的密闭容器中,充入一定量HI气体,发生如下可逆反应:2HI(g)⇌H2(g)+I2(g)△H>0.下列说法正确的是( )
- A、 若每消耗2n mol HI的同时生成n mol H2 , 表明该反应已达平衡
- B、 容器内的压强不发生变化,表明该反应已达平衡
- C、 平衡时,若其他条件不变,再充入一定量HI,重新达平衡后,I2的百分含量增大
- D、 平衡时,若其他条件不变,升高温度,混合气体的颜色加深
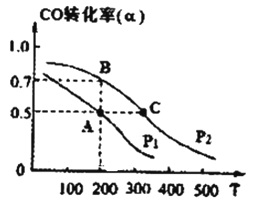
在一定条件下,反应X(g)+3Y(g)⇌2Z(g)△H=﹣92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )

- A、 图中A,B两点,达到相同的平衡体系
- B、 上述反应在达到平衡后,增大压强,H2的转化率提高
- C、 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
- D、 将1.0 mol X、3.0 mol Y,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
一定温度下,向2L恒容容器中充入1molA和1molB,发生反应A(g)+B(g)=C(g)经过一段时间后达到平衡,反应过程中测定的部分数据如表.下对说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 | |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
- A、 前 5 s 的平均反应速率v(A)=0.03 mol•L﹣1•s﹣1
- B、 正反应是吸热反应
- C、 保持温度不变,起始时向容器中充入2molC,达平衡时,C的转化率大于80%
- D、 保持温度不变,起始时向容器中充入0.2molA,0.2molB´和1molC,反应达到平衡前v(正)<v(逆)
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2 , 测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )
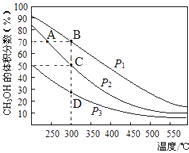
- A、 该反应的△H<0,且p1<p2
- B、 反应速率:ν逆(状态A)>ν逆(状态B)
- C、 在C点时,CO转化率为75%
- D、 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
在一定条件下,利用CO2合成CH3OH的反应如下:
CO2(g)+3H2(g)⇌H3OH(g)+H2O(g)△H1 ,
研究发现,反应过程中会有副反应:
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 .
温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )
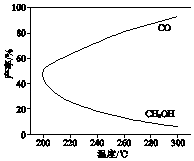
- A、 △H1<0,△H2>0
- B、 增大压强有利于加快合成反应的速率
- C、 生产过程中,温度越高越有利于提高CH3OH的产率
- D、 合成CH3OH反应的平衡常数表达式是K=
 2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法: