试题详情
室温下,H2C2O4的电离平衡常数Ka1= 5.9 ×10 -2 ,Ka2= 6.4 ×10 -5 , 用0.100 0 mol•L-1 NaOH溶液滴定20.00 mL 0.100 0 mol•L-1H2C2O 4溶液的曲线如图所示(体积变化忽略不计)。下列说法正确的是( )
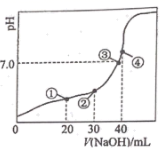
- A、滴定过程中,当 pH=4 时,存在:c(H+)+c(Na+ )=c(OH- )+c(
)+c(
)
- B、点①、③、④所示溶液中,点③所示溶液水的电离程度最大
- C、点③所示溶液:3c(
)+2c(
)+c(H2C2O4)=0.1 mol•L-1
- D、滴定过程中可能出现:c(Na+)>c(
)=c(
)>c(OH-)>c(H+)
知识点

参考答案