试题详情
实验测得 10 mL 0. 50 mol•L -1NH4Cl溶液、10 mL 0. 50 mol•L -1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25℃时CH3COOH和NH3•H2O的电离常数均为1. 8×10-5.下列说法错误的是( )
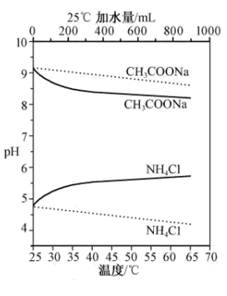
- A、加水稀释初期两种盐的水解率变化程度比稀释后期大
- B、图中虚线表示pH随加水量的变化,实线表示pH随温度的变化
- C、将NH4Cl溶液加水稀释至浓度
mol・L-1溶液pH变化值小于lgx
- D、将稀释相同倍数的NH4Cl与CH3COONa溶液混合,混合液中 c(CH3COO-)= c(NH
)
知识点

参考答案