试题详情
一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学。
①工业上用天然气和水蒸气在高温条件下发生反应,得到CO和H2 , 该反应的化学方程式为,得到的CO和H2的混合气被称为合成气,合成气在工业上可用于合成一系列化工原料和新型燃料,还可用于冶炼某些金属。
②某化学兴趣小组的同学在实验室模拟了合成气的制备,并设计实验验证合成气的还原性。
I.用甲烷和水蒸气在高温条件下反应得到合成气。根据①中所写的化学方程式,合成气中CO和H2的质量比为。
II.用合成气还原足量氧化铜.实验装置如下图所示:
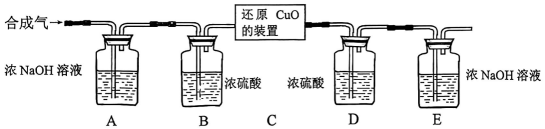
设计的实验步骤:
a.连接好装置并检查气密性。
b.装入药品,通入一段时间合成气。
c.分别称量装置D、E的质量。
d.缓缓通入合成气,加热装置C,使其充分反应。
e.停止加热,继续通入合成气至恢复到室温。
f.再次分别称量装置D、E的质量。
|
| 装置D的质量 | 装置E的质量 |
| 反应前 | 292.4g | 198.2g |
| 反应后 | 296.0g | 201.5g |
经过讨论同学们认为,装置E后还应添加一个酒精灯,并在实验步骤(填实验步骤的序号)中点燃(点燃前应对气体验纯)。
③该小组的同学按上述步骤进行实验;并记录了实验现象和数据:装置C中出现的现象是。
称量数据如右表所示。
I.甲同学根据装置C中的现象,认为是合成气中的CO和H2还原了CuO。写出任意一个化学方程式
。
II.乙同学通过对上表数据的分析,推测除了CO和H2以外,制得的合成气中未反应的CH4 , 也可能还原了CuO。试通过计算说明他的推测依据。
III.丙同学提出,实验步骤e中通入的气体会带走装置E中的部分水蒸气,使实验产生误差。你认为该误差对乙同学的推测结果是否有影响?并说明理由。
知识点

参考答案
采纳过本试题的试卷