试题详情
常温下,用0. 1000 mol·L-1的盐酸滴定20.00mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是( )
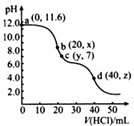
- A、若c(Na2CO3)=0.1000 mol·L-1 , 则H2CO3的Ka2数量级约为10-6
- B、c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-)
- C、a、c两点水的c(OH-)之比为10-11.6 :10-7
- D、若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-)
知识点

参考答案
采纳过本试题的试卷