单选题
化学无处不在,下列与化学有关的说法正确的是( )
- A、 氯气工厂爆炸时可用湿布捂住鼻孔、眼睛等并躲在下风的低洼处
- B、 二氧化硫可用来加工食品,使食品增白
- C、 锂可用于制造质量轻、电容量大的可充电电池
- D、 高纯度二氧化硅是制造太阳能电板的材料之一
在炼铁、制玻璃、制水泥三种工业生产中,都需要的原料是( )
- A、 生石灰
- B、 石灰石
- C、 石英
- D、 纯碱
下列说法中,正确的是( )
- A、 SiO2是硅酸的酸酐,可与水化合生成硅酸
- B、 CO2通入水玻璃中可以得到硅酸
- C、 在高温是SiO2与Na2CO3反应放出CO2 , 所以硅酸的酸性比碳酸强
- D、 SiO2是酸性氧化物,它不溶于任何酸
下列实验设计正确的是( )
- A、 将SO2通入溴水中证明SO2具有漂白性
- B、 将铁屑放入稀HNO3中证明Fe比H2活泼
- C、 将澄清石灰水滴入某溶液证明其中存在CO32﹣
- D、 将乙烯通入KMnO4酸性溶液证明乙烯具有还原性
下列有关物质应用的叙述中,不正确的是( )
- A、 氢氧化铝可用于治疗胃酸过多
- B、 ClO2用于饮用水消毒
- C、 水玻璃浸泡过的木材既能防腐又能耐火
- D、 Si用于制造光导纤维
下列事实能说明碳酸的酸性比乙酸弱的是( )
- A、 乙酸能发生酯化反应,而碳酸不能
- B、 碳酸和乙酸都能与碱反应
- C、 乙酸易挥发,而碳酸不稳定易分解
- D、 乙酸和Na2CO3反应可放出CO2
下列叙述正确的是( )
- A、 Na、C,P,S分别在足量氧气中燃烧均生成一种相应氧化物:Na2O2、CO2、P2O5、SO3
- B、 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳,浓硝酸、浓硫酸都能使铁、铝钝化
- C、 欲鉴别NO2、Br2(g)两种红棕色气体,将两种待测气体分別通入AgNO3溶液中
- D、 将久置于空气中的Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变为红色,说 明Fe(NO3)2样品在空气中已变质
“摇摇冰”是一种即用即冷的饮料.吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷.该化学物质是( )
- A、 氯化钠
- B、 固体硝酸铵
- C、 固体氢氧化钠
- D、 生石灰
下列关于氮的说法正确的是( )
- A、 N2分子的结构较稳定,因而氮气不能支持任何物质燃烧
- B、 23 g NO2和N2O4混合气含有0.5NA个氮原子(NA表示阿伏加德罗常数)
- C、 NO可用向上排空气法或者排水法收集
- D、 浓硝酸保存在棕色瓶内是因为硝酸易挥发
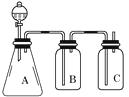
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( )

- A、 用装置甲制取氯气
- B、 用装置乙除去氯气中混有的少量氯化氢
- C、 用装置丙分离二氧化锰和氯化锰溶液
- D、 用装置丁蒸干氯化锰溶液制MnCl2•4H2O
下列有关说法,不正确的是( )
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②向煤中加入适量石灰石,在煤燃烧时最终生成CaSO4 , 可减少SO2对大气的污染
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3 , 取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3 .
- A、 仅①③④⑤
- B、 仅②③④
- C、 仅①③④
- D、 仅①②④⑤
以下物质间的每步转化,不能通过一步反应实现的是( )
- A、 S→SO2→H2SO4→MgSO4
- B、 Si→SiO2→Na2SiO3→H2SiO3
- C、 Al→Al2O3→Al(OH)3→NaAlO2
- D、 N2→NO→NO2→HNO3
下列操作或叙述正确的是( )
- A、 配制1mol•L﹣1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
- B、 用小刀切下一小块金属钠,将剩余的钠再放回原试剂瓶
- C、 向某溶液中加入BaCl2溶液产生白色沉淀,再加稀盐酸沉淀不溶解,说明原溶液中一定含有
- D、 向沸水中逐滴滴加1mol•L﹣1FeCl3溶液,并不断用玻璃棒搅拌,可制得Fe(OH)3胶体
氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是( )
- A、 新制氯水呈黄绿色,且有刺激性气味,说明氯水中含有Cl2
- B、 新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,可说明氯水中含有Cl2
- C、 向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明Cl2的氧化性强于I2
- D、 新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+
某溶液中含有较大量的Cl﹣、CO32﹣、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液.
- A、 ①②④②③
- B、 ④②①②③
- C、 ①②③②④
- D、 ④②③②①
有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀.对此实验下述结论正确的是( )
- A、 Na2SO3已部分被空气中的氧气氧化
- B、 加入Ba(NO3)2溶液后,生产的沉淀中一定含有BaSO4
- C、 加硝酸后的不溶性沉淀是BaSO3和BaSO4
- D、 此实验不能确定Na2SO3是否被部分氧化
对于某些离子的检验及结论一定正确的是( )
- A、 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32﹣
- B、 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣
- C、 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
- D、 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
下列说法正确的是( )
- A、 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染”
- B、 硅晶体的导电性介于导体与绝缘体之间,是一种重要的半导体材料,广泛应用于制造集成电路、光导纤维、太阳能电池板等
- C、 pH计不能用于酸碱中和滴定终点的判断
- D、 2013年11月22日,中科院国家纳米科学中心宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据.水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
近期,世界范围内有成千上万个湖泊变为鱼类绝迹的死湖,数以千万公顷计的森林衰败枯萎,大片土地沙漠化…将这些现象与频繁降落的酸雨相联系,人们认为,酸雨是肇事主因.某研究小组研究某地硫酸酸雨的形成,有人提出以下猜想:
猜想一:SO2 SO3
猜想二:SO2
猜想三:以上两过程同时存在
有关上述猜想,收集一定量该地区刚下的雨水进行实验,下列判断中错误的是( )
- A、 若猜想一或猜想三正确,则该雨水加入盐酸后,再加入BaCl2溶液,有白色沉淀生成
- B、 若存在猜想二的过程,则该雨水可能使品红褪色
- C、 若只存在猜想一的过程,则该雨水的pH随时间延长而增大
- D、 上述任意一个猜想正确,该地区雨水的pH均小于5.6