单选题
下列说法正确的是( )
- A、 放热的反应在常温下一定很易发生
- B、 吸热反应在一定条件下也能发生
- C、 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
- D、 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
下列措施肯定能使反应速率增大的是( )
- A、 适当升高温度
- B、 增大反应物的量
- C、 增大压强
- D、 减小生成物的量
下列关于盖斯定律的说法错误的是( )
- A、 不管反应是一步完成还是分几步完成,其反应热相同
- B、 反应热只与反应体系的始态和终态有关,而与反应的途径无关
- C、 有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
- D、 根据盖斯定律,热化学方程式中△H直接相加即可得总反应热
甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少了2molA,则甲容器内的反应速率比乙容器内的反应速率要( )
- A、 快
- B、 慢
- C、 相等
- D、 无法判断
在带有活塞的密闭容器中发生反应:Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g),采用下列措施不能改变反应速率的是( )
- A、 加热
- B、 保持容器体积不变,增加通入H2的量
- C、 充入N2 , 保持容器内压强不变
- D、 充入N2 , 保持容器内体积不变
下列事实中能用平衡移动原理解释的是( )
- A、 使用催化剂可加快氨的合成速率
- B、 在FeSO4溶液中,加入铁粉以防止氧化
- C、 由H2蒸气、I2蒸气、HI组成的平衡体系加压后颜色变深
- D、 硫酸工业生产中,通入过量空气以提高SO2的利用率
下列说法中正确的是( )
- A、 增大反应物浓度,能增大活化分子百分数,所以反应速率增大
- B、 使用正催化剂,能增大活化分子百分数,所以反应速率增大
- C、 对于任何反应,增大压强都可加快反应速率
- D、 升高温度,只能增大吸热反应的反应速率
下列有关“电离平衡”的叙述正确的是( )
- A、 电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等
- B、 电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡
- C、 电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动
- D、 电解质达到电离平衡后,各种离子的浓度相等
pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法错误的是( )
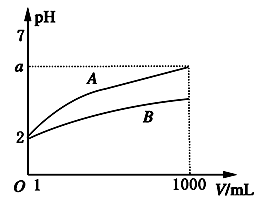
- A、 稀释后A溶液的酸性比B溶液弱
- B、 a=5时,A是强酸,B是弱酸
- C、 若A,B都是弱酸,则5>a>2
- D、 A,B两种酸溶液物质的量浓度一定相等
在下列溶液中,对应组离子一定能够大量共存的是( )
- A、 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
- B、 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
- C、 pH=12的溶液:K+、Ba2+、Cl-、Br-
- D、 碳酸氢钠溶液: K+、SO42-、Cl-、H+
根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g) △H=-297.23kJ/mol分析下列说法中错误的是( )
- A、 S(g)+O2(g)=SO2(g)放出的热量等于297.23kJ
- B、 S(g)+O2(g)=SO2(g)放出的热量大于297.23kJ
- C、 1molS(s)完全燃烧放热为297.23kJ
- D、 形成1molSO2(g)的化学键释放的总能量大于断裂1molS(s)和1molO2(g)的化学键所吸收的总能量
如图表示容积固定的2L密闭容器中进行的某一可逆反应:A(g)+2B(g  2C(g),以B的浓度改变表示的反应速度v正、v逆与时间的关系如图。已知v的单位为mol/(L·s),则图中阴影部分的面积可表示为 ( )
2C(g),以B的浓度改变表示的反应速度v正、v逆与时间的关系如图。已知v的单位为mol/(L·s),则图中阴影部分的面积可表示为 ( )
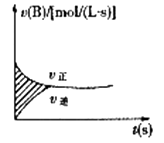
- A、 A物质的量浓度的减少值
- B、 B物质的量浓度的减少值
- C、 C物质的量增加值
- D、 B物质的量减少值
在温度不变的条件下,恒容密闭容器中发生如下反应:2SO2(g)+O2(g)  2SO3(g)下列叙述能够说明反应已达到平衡状态的是( )
2SO3(g)下列叙述能够说明反应已达到平衡状态的是( )
- A、 容器中SO2、O2、SO3共存
- B、 单位时间内生成2molSO2的同时消耗2molSO3
- C、 容器中SO2、O2、SO3的物质的量之比为1:1:1
- D、 反应容器中压强不随时间变化
已知: 2CO(g)+O2(g)=2CO2(g) △H=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) △H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
- A、 CO的燃烧热为283kJ
- B、 下图可表示由CO生成CO2的反应过程和能量关系
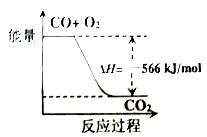
- C、 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)放出的热量小于452kJ
- D、 Na2O2(s)+CO(g)=Na2CO3(s) △H=-1018 kJ/mol
把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:
3A(气)+B(气) 2C(气)+。X D(气)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/L•min,下列说法中错误的是 ( )
- A、 x = 2
- B、 B的转化率为20%
- C、 平衡时A的浓度为0.75mol/L
- D、 恒温达平衡时容器内压强为开始时的85%
密闭容器中发生如下反应mA(g)+nB(g)  pC(g)+qD(s),达平衡后,温度一定时,将气体体积缩小到原来的
pC(g)+qD(s),达平衡后,温度一定时,将气体体积缩小到原来的  ,当达新平衡时,C的浓度为原来的1.9倍,则下列推断正确的是( )
,当达新平衡时,C的浓度为原来的1.9倍,则下列推断正确的是( )
- A、 平衡向正向移动了
- B、 达新平衡时,容器内总压一定比原平衡的2倍小
- C、 达新平衡时,A的浓度小于原平衡A浓度的2倍
- D、 m+n>p+q
在密闭容器中进行下列反应:M(g)+N(g)  R(g)+2L,此反应符合下列图像,下列叙述正确的是( )
R(g)+2L,此反应符合下列图像,下列叙述正确的是( )
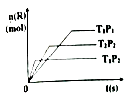
- A、 正反应放热,L是气体
- B、 逆反应放热,L是固体
- C、 正反应吸热,L是气体
- D、 正反应放热,L是固体或液体
在一定条件下有反应:2SO2(g)+O2(g)  2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述错误的是:( )
- A、 Q1<197
- B、 在上述条件下,反应生成1molSO3气体放热98.5kJ
- C、 Q2=Q3
- D、 Q3<Q1<2Q2
根据下列有关图象,说法正确的是( )
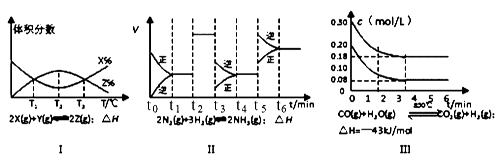
- A、 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
- B、 由图Ⅱ知,反应在t6时,NH3体积分数最大
- C、 由图Ⅱ知,t3时采取的措施是降低反应体系温度
- D、 Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量