单选题
下列物质溶于水后溶液显酸性的是( )
- A、 KCl
- B、 Na2O
- C、 NH4Cl
- D、 CH3COONa
相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是( )
- A、 相同浓度的两溶液,分别与镁粉反应,开始时反应速率相同
- B、 相同浓度的两溶液,c(CH3COOˉ) <c(Clˉ)
- C、 分别中和pH相等、体积相等的两溶液,盐酸所需NaOH的物质的量较多
- D、 pH=3的两溶液分别加水稀释10倍后,醋酸溶液的pH比盐酸大
下列有关电解质溶液的说法正确的是( )
- A、 向K2S溶液中加水稀释,
会减小
- B、 向醋酸溶液中加NaOH至恰好完全反应,水的电离程度先增大后减小
- C、 向含有MgCO3同体的溶液中加入少量盐酸,
会增大
- D、 向CuS和FeS的饱和溶液中加入少量Na2S,
保持不变
完成下列实验目的,相关实验设计正确的是( )
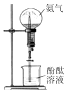
- A、 氨气喷泉实验
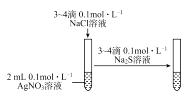
- B、 比较AgCl和Ag2S的Ksp大小
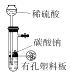
- C、 实验室制备CO2待用
- D、 测定盐酸浓度

已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14 , 三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是( )

- A、 a线是CaSO4沉定溶解平衡曲线
- B、 T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=
- C、 d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
- D、 T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比试验,④产生白色沉淀多。下列说法错误的是( )
- A、 Na₂SO3溶液中存在水解平衡:SO32-+H2O
HSO-3+OH-
- B、 ④的pH与①不同,是由于SO32-浓度减小造成的
- C、 ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
- D、 ①与④的Kw值相等
物质的量浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是( )
- A、 两溶液加入等质量的锌粉,产生氢气的速率相同
- B、 两溶液中氢氧根离子浓度均为
mol/L
- C、 加入醋酸钠固体,二者的pH均增大
- D、 与氢氧化钠反应至中性时,二者消耗氢氧化钠的质量相同
常温下,含碳微粒(H2C2O4、HC2O4-、C2O42-)存在于0.1mol/L草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数ω(某微粒物质的量浓度与三种微粒物质的量浓度和比值)与溶液pH的关系如图所示,下列有关说法错误的是( )
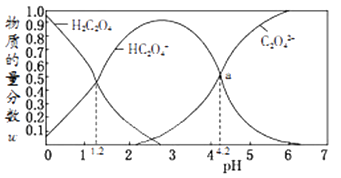
- A、 向pH=1.2的溶液中加NaOH溶液将pH增大至4.2的过程中水的电离度一直增大
- B、 pH=4.2时,溶液中c(Na+)>c(HC2O4-)+c(C2O42-)
- C、 若草酸的第二级电离平衡常数为K2 , 则lgK2=-4.2
- D、 将0.1mol/L相同物质的量浓度NaHC2O4和Na2C2O4的两份溶液等体积混合,可配得上图a点所示混合液
砷(As)是一些工厂和矿山废水中的污染元素。常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是( )
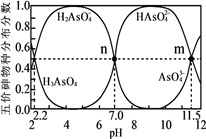
- A、 Na2HAsO4溶液显碱性
- B、 H3AsO4溶液pKa2为2.2
- C、 m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1
- D、 n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)
室温下,浓度均为0.1mol/L.体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH 与  的变化关系如图所示。下列叙述正确的是( )
的变化关系如图所示。下列叙述正确的是( )
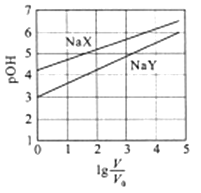
- A、 HX、HY都是弱酸,且Ka(HX)>Ka(HY)
- B、 图中pOH随
变化始终满足直线关系
- C、
=3时,NaX溶液中所含离子总数小于NaY溶液
- D、 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
常温下,向100mL0.1mol/LNH4Cl溶液中,逐滴滴加0.1mol/L NaOH溶液。NH4+和NH3·H2O的变化趋势如图所示(不考虑NH3的逸出)。下列说法正确的是( )
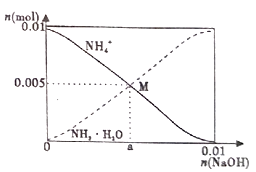
- A、 M点溶液中水的电离程度比原溶液大
- B、 在M点时,n(H+)-n(OH-)=(0.005-a)mol
- C、 随着NaOH溶液的滴加,
不断增大
- D、 当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)
下图所示与对应叙述不相符的是( )








- A、 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
- B、 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
- C、 25℃时,图丙表示用0.100mol·L-1的NaOH溶液滴定25.00mL盐酸的滴定曲线,则c(HCl)=0.080mol·L-1
- D、 图丁表示反应N2(g)+3H2(g)
2NH3(g)平衡时NH3体积分数随起始
变化的曲线,则转化率:aA(H2)<aB(H2)
向浓度均为0.010mol·L-1的Na2CrO4、NaBr和NaCl的混合溶液中逐滴加入0.010mol·L-1的AgNO3溶液。[已知Ksp(AgCl)=1.77×10-10 , Ksp(Ag2CrO4)=1.12×10-12 , Ksp(AgBr)=5.35×10-13 , Ag2CrO4为砖红色],下列叙述正确的是( )
- A、 原溶液中n(Na+)=0.040mol
- B、 Na2CrO4 可用作AgNO3溶液滴定Cl-或Br-的指示剂
- C、 生成沉淀的先后顺序是AgBr一Ag2CrO4一AgCl
- D、 出现Ag2CrO4沉淀时,溶液中c(Cl-):c( Br-)=177:535