单选题
利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是( )

- A、 相比现有工业合成氨,该方法条件温和,同时还可提供电能
- B、 阴极区,在氢化酶作用下发生反应H2+2MV2+=2H++2MV+
- C、 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
- D、 电池工作时质子通过交换膜由负极区向正极区移动
我国科学家研发了一种新型液硫二次电池,其工作原理如图所示。下列说法错误是( )

- A、 放电时,电池左侧为负极,发生氧化反应
- B、 充电时,电解质溶液中K+经交换膜向右侧移动
- C、 放电时,电池右侧的电极反应为I3-+2e-=3S2-+I3-
- D、 充电时,电池的总反应为S22-+3I-
2S2-+I3-
已知CuCl难溶于水。电解合成1,2一二氯乙烷的实验装置如图所示。下列说法中不正确的是( )

- A、 阳极反应式:CuCl-e-=Cu2++Cl-
- B、 CuCl2能将C2H4氧化为1,2-二氯乙烷
- C、 Ⅹ、Y依次为阳离子交换膜、阴离子交换膜
- D、 该装置总反应为CH2=CH2+2H2O+2NaCl
H2↑+2NaOH+ ClCH2CH2Cl
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)  ZnO(s)+2Ni(OH)2(s)。下列说法错误的是( )
ZnO(s)+2Ni(OH)2(s)。下列说法错误的是( )

- A、 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
- B、 充电时阳极反应为Ni(OH)2(s)+OH−(aq)−e−=NiOOH(s)+H2O(l)
- C、 放电时负极反应为Zn(s)+2OH−(aq)−2e−=ZnO(s)+H2O(l)
- D、 放电过程中OH−通过隔膜从负极区移向正极区
某兴趣小组设计如下微型实验装置。实验时,发现断开K2 , 闭合K1 , 两极均有气泡产生;一段时间后,断开K1 , 闭合K2 , 发现电流表指针偏转,下列有关描述正确的是( )

- A、 断开K2 , 闭合K1时,石墨电极上的电极反应式为:2 H++ 2e-=H2↑
- B、 断开K1 , 闭合K2时,铜电极上的电极反应式为:Cl2 + 2e-=2Cl-
- C、 甲装置属于燃料电池,该电池正极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
- D、 甲烷燃料电池的总电极反应式为:CH4+2O2 +2NaOH=Na2CO3+3H2O
生产硝酸钙的工业废水常含有NH4NO3 , 可用电解法净化。其工作原理如图所示。下列有关说法正确的是( )

- A、 a极为电源负极,b极为电源正极
- B、 装置工作时电子由b极流出,经导线、电解槽流入a极
- C、 Ⅰ室能得到副产品浓硝酸Ⅲ室能得到副产品浓氨水
- D、 阴极的电极反应式为2NO3-+12H++10e-=N2↑+6H2O
电渗析法淡化海水装置示意图如下,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是( )

- A、 离子交换膜b为阳离子交换膜
- B、 各间隔室的排出液中,①③⑤⑦为淡水
- C、 通电时,电极l附近溶液的pH比电极2附近溶液的pH变化明显
- D、 淡化过程中,得到的浓缩海水没有任何使用价值
下图甲是一种在微生物作用下将废水中的尿素CO(NH2)2转化为环境友好物质,实现化学能转化为电能的装置,并利用甲、乙两装置实现在铁上镀铜。下列说法中错误的是( )

- A、 乙装置中溶液颜色不变
- B、 铜电极应与Y相连接
- C、 M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
- D、 当N电极消耗0.25 mol气体时,铜电极质量减少16g
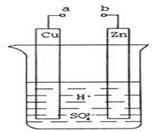
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
- A、 电池工作时,正极反应式为O2+2H2O+4e-=4OH-
- B、 电解时,电子流动路径是负极→外电路→阴极→溶液→阳极→正极
- C、 试管中NaOH溶液用来吸收电解时产生的Cl2
- D、 当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.021 mol气体
如下图所示  、
、  装置电解氯化铜溶液和饱和食盐水。下列判断错误的是( )
装置电解氯化铜溶液和饱和食盐水。下列判断错误的是( )

- A、 阳极失电子的离子相同、产物相同
- B、 阴极产物因得电子的离子不同而不同
- C、 电解后两装置中溶液的pH都减小
- D、 电解后只有
装置阴极的质量增加
对下图所示的钢铁电化学保护方法,分析正确的是()

- A、 是牺牲阳极的阴极保护法
- B、 钢闸门失去电子
- C、 电子从负极流向阴极
- D、 电子从阴极经海水流向阳极
下列图中的实验方案,能达到实验目的的是( )
| 实验方案 | | | | |
| 目的 | A.验证升高温度可加快H2O2分解 | B.精练铜 | C.验证AgCl沉淀 可以转变为Ag2S | D.探究浓度对化学 反应速率的影响 |
- A、 A
- B、 B
- C、 C
- D、 D
用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
- A、 AgNO3 CuCl2 Cu(NO3)2
- B、 KCl Na2SO4 CuSO4
- C、 CaCl2 KOH NaNO3
- D、 HCl HNO3 K2SO4
关于下列各装置图的叙述中,错误的是( )

- A、 用装置①精炼铜,则a极为电源正极,电解质溶液可为CuSO4溶液
- B、 用湿润的淀粉-KI试纸检验装置②中阳极气体产物时,试纸变为蓝色
- C、 装置③中钢闸门应与外接电源的负极相连,该保护法称为“牺牲阳极的阴极保护法”
- D、 装置④中反应一段时间后,取Fe电极附近溶液滴加铁氰化钾溶液,不会产生蓝色沉淀
若要在铜片上镀银时,下列叙述错误的是( )
①将铜片接在电源的正极 ②将银片接在电源的正极 ③在铜片上发生的反应是:Ag+ +e-=Ag ④在银片上发生的反应是:4OH- - 4e-=O2 +2H2O ⑤可用硫酸溶液作电解质 ⑥可用硝酸银溶液作电解质
- A、 ①③⑥
- B、 ②③⑥
- C、 ①④⑤
- D、 ②③④⑥
如图所示的装置,C、D、E、F、X、Y都是惰性电极,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,则以下说法正确的是( )

- A、 电源B极是正极
- B、 装置(丁)中X极附近红褐色变深,说明氢氧化铁胶粒带正电荷
- C、 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
- D、 (甲)、(乙)装置的C,D,E,F电极均有单质生成,其物质的量之比为1 : 2 : 2 : 2
用惰性电极电解足量的下列溶液,一段时间后,加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
- A、 CuCl2[CuSO4]
- B、 NaOH[H2O]
- C、 NaCl[H2O]
- D、 CuSO4[Cu(OH)2]