单选题
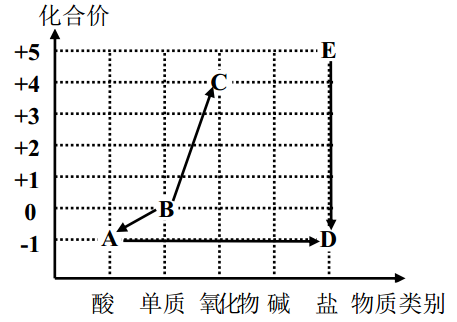
北宋沈括在《梦溪笔谈》中记载了用“苦泉水”制取铜的方法,其主要生产流程如图所示。下列解释合理的是( )
- A、 ①通过蒸发溶剂可获得晶体
- B、 ②是通过复分解反应获得铜
- C、 ③所得硫酸铜溶液一定是饱和的
- D、 ④说明铁元素变成了铜元素
法美三位科学家荣获2005年度诺贝尔化学奖,获奖原因就是他们弄清了如何指挥烯烃分子“交换舞伴”,将分子部件重新组合成别的物质。在烯烃分子里,两个碳原子就像双人舞的舞伴一样,拉着双手在跳舞。随之不同的烯烃分子间经过“交换”后生成了新物质,其过程可用右图表示:这种不同烯烃间重新组合成新物质的过程,可以认为是烯烃分子间发生了( )

- A、 置换反应
- B、 化合反应
- C、 复分解反应
- D、 分解反应
二氧化氯是新一代自来水消毒剂,如图为制取二氧化氯的化学反应模型。下列有关说法正确的是( )

- A、 参加反应的X、Y个数之比为2:1
- B、 该反应属于复分解反应
- C、 氯元素在物质Y中显-1价
- D、 X、Y、Z、W均为化合物
自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示,下列说法正确的是( )

- A、 反应中氯元素的化合价有两种
- B、 图甲的反应为复分解反应,图乙为分解反应
- C、 c物质通到硝酸银溶液中,能产生白色沉淀
- D、 图中各分子稳定性都很差
质量守恒定律是化学反应中的重要规律。在催化、加热的条件下,A与B反应生成C和D,反应前后分子变化的微观示意图如右所示,下列说法正确的是( )

- A、 该化学反应属于复分解反应
- B、 4种物质中,C,D都属于氧化物
- C、 反应前后,氮元素化合价保持不变
- D、 该反应物中反应物A与B分子个数比是1:1
如图是小凡用手势OK表示初中化学反应中生成水的不同方法,要求手指上的物质分别通过某种基本类型的反应能直接生成H2O,则物质X一定不是下列物质中的( )

- A、 H2
- B、 H2CO3
- C、 KOH
- D、 CH4
已知复分解反应2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑可进行.在常温下,测得相同浓度的下列六种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 7.8 | 8.6 | 11.3 | 10.2 | 11.1 |
表中数据揭示出复分解反应的一条规律,即碱性较强的物质发生类似反应可以生成碱性弱的物质.依照该规律,请你判断下列反应不能成立的是( )
- A、 CO2+H2O+2NaClO=Na2CO3+2HClO
- B、 CO2+H2O+NaClO=NaHCO3+HClO
- C、 CH3COOH+NaCN=CH3COONa+HCN
- D、 NaClO+CH3COOH=HClO+CH3COONa
英国化学家亨利·卡文迪许是燃素说的信仰者。1766 年,他用铁、锌、锡等六种金属与稀硫酸、稀盐酸作用制得“可燃空气”,并将其表示为:

用所学化学知识判断,下列说法正确的是( )
- A、 “可燃空气”是从金属中分解出来的
- B、 上述六种金属包括铜
- C、 “可燃空气”可以用排水集气法收集
- D、 上述反应属于复分解反应
对于反应:X + 2 NaOH = 2 Y + Cu(OH)2↓ ,下列分析中正确的是( )
- A、 Y 中一定没有钠元素
- B、 X 和Y 的相对分子质量之差为18
- C、 X 可能是CuCl2或Cu(NO3)2
- D、 Y 可能是Na2SO4
C→CO2→H2CO3→Na2CO3表示四种物质之间的转化均由一步反应实现,则上述化学反应中肯定不包括( )
- A、 化合反应
- B、 分解反应
- C、 置换反应
- D、 复分解反应
甲、乙两化工厂分布如图所示。箭头代表水流方向。如果在a处取得水样经检测只有少量OH-、SO42-。在c处取得水样经检测pH=7且只含有少量NaCl。则b处水中含有的物质应是下列那一组?( )

- A、 MgSO4、NaCl
- B、 H2SO4、Ba(NO3)2
- C、 BaCl2、HCl
- D、 H2SO4、MgCl2
下列各组物质的溶液混合后能发生复分解反应,但不产生沉淀和气体的是( )
- A、 碳酸钾和硫酸
- B、 硝酸钾和硫酸钠
- C、 氢氧化钙和盐酸
- D、 硫酸铜和氢氧化钠
下列属于复分解反应类型的是( )
- A、 Mg +2HCl==MgCl2+H2 ↑
- B、 Cu(OH)2 + H2SO4=CuSO4 + H2O
- C、 3Fe+2O2
Fe3O4
- D、 2KMnO2
K2MnO4+MnO2+O2↑
下列反应属于复分解反应的是( )
- A、 CaO+2H2O=Ca(OH)2
- B、 2H2O2
2H2O↑+O2↑
- C、 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
- D、 Zn+H2SO4=ZnSO4+H2↑
下列各反应中,属于复分解反应的是( )。
- A、 Zn+H2SO4(稀)=ZnSO4+H2↑
- B、 C+H2O
CO+H2
- C、 CH4+2O2
CO2+2H2O
- D、 Cu(OH)2+H2SO4=CuSO4+2H2O