单选题
化学反应原理是研究化学的重要工具,下列相关说法正确的是( )
- A、 CH4(g)+Cl2(g)
CH3Cl(g)+HCl(g)能自发进行,则该反应
H>0
- B、 向碳酸钠溶液中通入少量的氯气:Na2CO3+H2O+2Cl2=2HClO+2NaCl+CO2
- C、 室温下,稀释0.1 mol/L的HClO溶液,溶液中c(ClO-)减小
- D、 向硫酸钡悬浊液中加入足量饱和碳酸钠溶液,振荡过滤洗涤,向沉淀中加入盐酸溶液有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
某温度下,向体积均为20.00 mL、浓度均为0.1 mol·L-1的NaCl、Na2CrO4溶液中分别滴加0.1 mol·L-1的AgNO3溶液,滴定过程中的pX(pX=-lgX,X=Cl-、CrO  )与滴加AgNO3溶液体积关系如图所示(lg3=0.47)。下列说法错误的是( )
)与滴加AgNO3溶液体积关系如图所示(lg3=0.47)。下列说法错误的是( )

- A、 a=1
- B、 曲线I表示NaCl溶液
- C、 Ksp(Ag2CrO4)=1.0×10-2b
- D、 M约为2c-1.47
下列说法错误的是( )
- A、 升高HCl稀溶液温度,溶液中c(H+)不变
- B、 常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-)
- C、 向AgCl、AgBr的饱和溶液中加入少量AgNO3固体,溶液中氯离子浓度和溴离子浓度比不变
- D、 25℃时,将0.1mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.0
天然水体中的H2CO3与空气中的CO2保持平衡。已知Ksp(CaCO3)=2.8×10-9 , 某溶洞水体中lgc(X) (X为H2CO3、  、
、  或Ca2+)与pH的关系如图所示。下列说法正确的是( )
或Ca2+)与pH的关系如图所示。下列说法正确的是( )

- A、 曲线①代表
- B、 H2CO3的一级电离常数为10-8.3
- C、c(Ca2+)随 pH升高而增大
- D、 pH=10.3 时,c(Ca2+)=2.8×10-7.9 mol·L-1
某温度下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的KCl溶液和K2CrO4溶液中滴加0.1 mol·L-1的AgNO3溶液,滴加过程中pCl和pCrO4随加入AgNO3溶液的体积(V)的变化关系如图所示。已知:pCl=-lgc(Cl-),pCrO4=-lgc(  )。下列说法错误的是( )
)。下列说法错误的是( )

- A、 曲线I表示pCl与V(AgNO3溶液)的变化关系
- B、 若仅增大KCl的浓度,平衡点由R点沿虚线移向S点
- C、 M点溶液中:c(
)>c(Ag+)>c(H+)>c(OH-)
- D、 该温度下,Ksp(Ag2CrO4)=4.0×10-12
根据下列图示所得出的结论错误的是( )
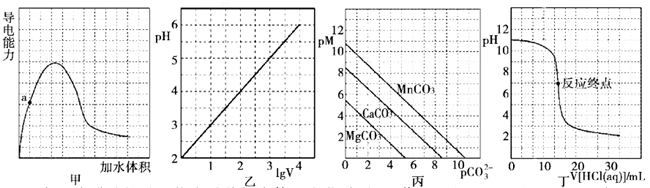
- A、 图甲表示冰醋酸的导电能力随着加水体积变化关系图,若用湿润的
试纸测量a点的
,则测量结果可能偏小
- B、 图乙表示
的盐酸溶液加水稀释至
随
的变化关系图
- C、 图丙表示一定温度下三种碳酸盐
的沉淀溶解平衡曲线图
,则有
、
、
的
依次减小
- D、 图丁表示
盐酸滴定
溶液的滴定曲线
化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)  CuS(s)+Mn2+(aq)。一定温度下,下列有关该反应的推理正确的是( )
CuS(s)+Mn2+(aq)。一定温度下,下列有关该反应的推理正确的是( )
- A、 该反应达到平衡时:c(Cu2+)=c(Mn2+)
- B、 平衡体系中加入少量CuS(s)后,c(Mn2+)变小
- C、 平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
- D、 该反应平衡常数表达式:K=Ksp(CuS)/Ksp(MnS)
现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是( )
①20mL 0.01mol·L-1 KCl溶液 ②30mL 0.02mol·L-1 CaCl2溶液③40mL 0.03mol·L-1 HCl溶液
- A、 ①>③>②
- B、 ①>②>③
- C、 ②>①>③
- D、 ③>②>①
某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下PbCO3和PbI2在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(  )或-lgc(I-)的关系如图所示。下列说法正确的是( )
)或-lgc(I-)的关系如图所示。下列说法正确的是( )

- A、 Ksp(PbCO3)的数量级为10-14
- B、 p点对应的是PbCO3不饱和溶液
- C、 L2对应的是-lgc(Pb2+)与-lgc(I-)的关系变化
- D、 向浓度相同的Na2CO3、Nal混合溶液中滴入Pb(NO3)2溶液先产生黄色沉淀
已知相同温度下,  。某温度下,饱和溶液中
。某温度下,饱和溶液中  、
、  、与
、与  的关系如图所示。
的关系如图所示。

下列说法正确的是( )
- A、 曲线①代表
的沉淀溶解曲线
- B、 该温度下
的
值为
- C、 加适量
固体可使溶液由a点变到b点
- D、
时两溶液中
室温下,分别向体积均为20mL、浓度均为0.1mol·L-1的HX、HY溶液中,滴加相同浓度的Ba(OH)2溶液(Ba2+与X-、Y-均不反应)。随着Ba(OH)2溶液的加入,由水电离产生的c(H+)的变化趋势如图所示。下列说法错误的是( )

- A、 相同条件下,Ka(HX)>Ka(HY)
- B、 M点溶液显中性,溶液中c(Y-)<c(Ba2+)
- C、 N点对应Ba(OH)2溶液的体积为10mL
- D、 T点溶液中阴离子浓度之和大于M点
 回答下列问题:
回答下列问题: 溶液中金属离子开始沉淀和完全沉淀的pH如表所示,回答下列问题:
溶液中金属离子开始沉淀和完全沉淀的pH如表所示,回答下列问题: