单选题
能量通常包括热能、电能、光能、机械能、化学能等,下列有关能量转化关系的判断错误的是( )
- A、 甲烷燃烧:化学能转化为热能和光能
- B、 植物进行光合作用:太阳能转化为化学能
- C、 二次电池放电:电能转化为化学能
- D、 风力发电:风能转化为机械能,机械能转化为电能
根据下图所示情况,判断下列说法中正确的是( )
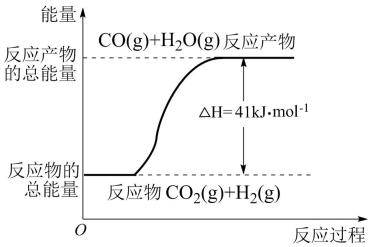
- A、 其热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41kJ·mol-1
- B、 该反应为吸热反应
- C、 1 mol CO具有的能量比1 mol CO2具有的能量高
- D、 当H2O为液态时,其反应热大于41 kJ·mol-1
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
- A、 加热
- B、 改用98%浓硫酸
- C、 滴加少量CuSO4溶液
- D、 改用铁粉
自嗨锅的发热包主要成分有:硅藻土、铁粉、铝粉、焦炭粉、盐、生石灰,使用时使发热包里面的物质与水接触即可。下列说法错误的是( )
- A、 铁粉发生析氢腐蚀,缓慢放出热量,延长放热时间
- B、 硅藻土可增大反应物的接触面积
- C、 主要反应物为生石灰,与水反应放热
- D、 使用后的发热包属于有害垃圾
某铜锌原电池的结构如图所示,下列说法正确的是( )
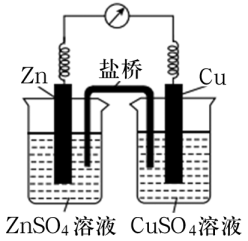
- A、 Zn电极为该原电池的正极
- B、 电池工作时,电子由Zn电极流出,经溶液和盐桥流入Cu电极
- C、 Cu电极上的电极反应式为Cu-2e-=Cu2+
- D、 若盐桥中的电解质为KCl,则电池工作时K+向右侧移动
下列说法错误的是( )
- A、 工业合成氨中,升温有利于提高反应速率和原料平衡转化率
- B、 对于任何化学反应来说,反应速率加快,反应进行的程度不一定增大
- C、 平衡移动,平衡常数不一定改变;平衡常数改变,平衡一定移动
- D、 化学平衡正向移动,正反应速率不一定增大
下列有关热化学方程式的叙述正确的是( )
- A、 已知C(石墨,s) = C(金刚石,s) ΔH>0,则金刚石比石墨稳定
- B、 2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ·mol−1 , 则CO的摩尔燃烧焓为283 kJ∙mol−1
- C、 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) ΔH=−57.4 kJ∙mol−1
- D、 已知2C(s)+2O2(g) =2CO2(g) ΔH1;2C(s)+O2(g) =2CO(g) ΔH2 , 则ΔH1>ΔH2
下列说法正确的是( )
- A、 一定温度下,反应MgCl2(l)
Mg(l)+Cl2(g)的ΔH>0,ΔS<0
- B、 凡是放热反应都是自发的,凡是吸热反应都是非自发的
- C、 常温下,2H2O
2H2↑+O2↑,即常温下水的分解反应是自发反应
- D、 已知2KClO3 (s) =2KCl(s) + 3O2(g) ΔH=﹣78.03 kJ·mol-1 , ΔS=+ 494.4 J·mol-1·k-1 , 此反应在任何温度下都能自发进行
在一密闭容器中发生反应:2A(g)+B(s)⇌3C(g) ΔH<0,达到平衡时,下列说法正确的是( )
- A、 移走少量B,平衡逆向移动,A的转化率降低
- B、 扩大容积,减小压强,平衡不移动
- C、 保持体积恒定,加入少量A,B的转化率增大
- D、 保持体积恒定,加入少量C,C的体积分数增大
对于可逆反应N2(g)+3H2(g)⇌2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D |
|
|
|
|
研究压强对反应的影响(p2>p1) | 研究温度对反应的影响 | 研究平衡体系增加N2对反应的影响 | 研究催化剂对反应的影响 |
- A、 A
- B、 B
- C、 C
- D、 D
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如图。以下结论错误的是( )


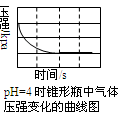
- A、 溶液pH≤2时,生铁发生析氢腐蚀
- B、 在酸性溶液中生铁有可能发生吸氧腐蚀
- C、 析氢腐蚀的速率比吸氧腐蚀快
- D、 两溶液中负极反应均为:Fe-2e-=Fe2+
已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g) +2H2O(l) ΔH1=﹣870.3 kJ·mol-1
②C(s) +O2(g) =CO2(g) ΔH2=﹣393.5 kJ·mol-1
③H2(g) +O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
则反应2C(s) +2H2(g) +O2(g)=CH3COOH(l)的焓变ΔH为( )
- A、 ﹣488.3 kJ·mol-1
- B、 ﹣224.15 kJ·mol-1
- C、 488.3 kJ·mol-1
- D、 244.15 kJ·mol-1




