选择题
下列化合物中,能与Na2CO3溶液反应生成沉淀且沉淀可溶于NaOH溶液的是( )
- A、 MgCl2
- B、 Ca(NO)3
- C、 FeSO4
- D、 AlCl3
下列指定反应的离子方程式正确的是( )
- A、 饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4
CaCO3+SO42−
- B、 酸化NaIO3和NaI的混合溶液:I− +IO3−+6H+=I2+3H2O
- C、 KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3=2FeO42−+3Cl−+4H++H2O
- D、 电解饱和食盐水:2Cl−+2H+
Cl2↑+ H2↑
室温下,下列各组离子在指定溶液中能大量共存的是( )
- A、 0. 1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH−
- B、 0. 1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+、NO3−、SO42−
- C、 0. 1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3−
- D、 0. 1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−
侯德榜先生于1943年创立了“侯氏制碱法”。该工艺中一般不涉及的离子反应是( )
- A、
- B、
- C、
- D、
+5价V在不同pH下微粒的化学式不同,其微粒与pH关系如表所示。
含钒元素的不同微粒 | VO | VO | V2O | VO |
pH | 4~6 | 6~8 | 8~10 | 10~12 |
另外,V价态不同在溶液中颜色不同,如V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO(黄色)、VO
(无色)、V5O
(红棕色)等。下列说法正确的是( )
- A、 VO
转化为V2O
的离子反应为2VO
+H2O=V2O
+2H+
- B、 含VO
的溶液中滴加氨水有NH4VO3沉淀产生,该过程V元素被还原
- C、 酸性VO
滴加烧碱溶液,溶液显红棕色时离子反应为5VO
+8OH-=V5O
+4H2O
- D、 紫色VSO4溶液中滴加酸性高锰酸钾溶液,溶液颜色出现绿色→蓝色→黄色,两个过程均失去1mol电子
下列关于离子共存或者离子反应的说法正确的是( )
- A、
溶液可能大量存在:
、
、
、
- B、 用NaOH溶液吸收过量CO2:
- C、
氯化亚铁溶液:Na+、
、
、MnO
- D、 氢氧化铁和碘化氢溶液反应:
常温下,用一定浓度的盐酸滴定某浓度的氨水。滴定终点附近溶液的pH和导电能力的变化如图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是( )

- A、 a点对应的溶液中:
- B、 a→b过程中,
不断增大
- C、 c→d溶液导电性增强的主要原因是
和
增大
- D、 根据溶液pH和导电能力的变化可判断:
某化学实验室产生的废液中的阳离子只可能含有Na+、NH4+、Ba2+、Cu2+、Al3+、Fe2+、Fe3+中的某几种,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。

已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是( )
- A、 根据步骤①的现象,说明废液中一定含有Al3+
- B、 由步骤②中红棕色固体可知,废液中一定存在Fe3+
- C、 沉淀甲中可能含有Al(OH)3
- D、 该废液中一定含有NH4+、Ba2+、Cu2+、Fe2+和Fe3+至少存在一种
下列各组反应中不属于离子反应的是( )
- A、 NaCl与AgNO3反应
- B、 FeCl3与Cu反应
- C、 Na2O与H2O反应
- D、 在氧气中点燃氢气
不能用离子方程式Ca2++CO32- →CaCO3↓表示的反应是( )
- A、 澄清石灰水和碳酸
- B、 澄清石灰水和碳酸钠溶液
- C、 硝酸钙溶液和碳酸铵溶液
- D、 氯化钙溶液和碳酸钾溶液
向明矾溶液中逐滴加入Ba(OH)2溶液,当SO42-全部沉淀时,铝元素的主要存在形式为( )
- A、 Al3+
- B、 AlO2-
- C、 Al(OH)3
- D、 Al(OH)3、AlO2-
在pH=13的某溶液中存在大量的Na+、ClO-、NO3- , 该溶液还可能大量存在的离子是( )
- A、 NH4+
- B、 HCO3-
- C、 SO42-
- D、 Al3+
某无色溶液中可能存在Br-、CO32-、SO32-、Fe3+、I-、Mg2+、Na+等例子中的某几种,现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液肯定不存在的大量离子是( )
- A、 Fe3+、SO32-、I-
- B、 Mg2+、CO32-、I-
- C、 Fe3+、Mg2+、SO32-
- D、 Na+、Br-、CO32-
解释下列事实的方程式正确的是( )
- A、 纯碱溶液显碱性:CO32-+2H2O
H2CO3+2OH-
- B、 用稀硝酸清洗试管内壁附着的银:Ag+2H++NO3-=Ag++NO2↑+H2O
- C、 向煤中加入石灰石可减少煤燃烧时SO2的排放:CaCO3+O2+SO2= CO2+CaSO4
- D、 碳酸氢钠溶液与过量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O
常温下,向100mL0.1mol/LNH4Cl溶液中,逐滴滴加0.1mol/L NaOH溶液。NH4+和NH3·H2O的变化趋势如图所示(不考虑NH3的逸出)。下列说法正确的是( )
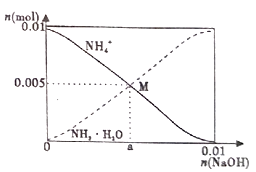
- A、 M点溶液中水的电离程度比原溶液大
- B、 在M点时,n(H+)-n(OH-)=(0.005-a)mol
- C、 随着NaOH溶液的滴加,
不断增大
- D、 当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)
下列物质之间进行反应时,可用离子方程式2H+ + CO32- → H2O+CO2 ↑表示的是( )
- A、 碳酸钠溶液中加入足量醋酸溶液
- B、 碳酸钡和稀硝酸反应
- C、 碳酸氢钠溶液中加入少量稀硫酸
- D、 在盐酸溶液中滴入少量碳酸钾溶液
某溶液含有①NO3-、②HCO3- 、③SO32- 、④CO32- 、⑤SO42-等五种阴离子。向其中加入少量的Na2O2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化)( )
- A、 ①
- B、 ①⑤
- C、 ①④⑤
- D、 ①③④⑤
下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是( )
- A、 Mg2+、Na+、SO42-、Cl-
- B、 K+、CO32-、Cl-、NO3-
- C、 Na+、K+、NO3-、SO32-
- D、 NH4+、Na+、SO42-、NO3-
已知分解1mol H2O2放出热量98kJ。在含有少量I-的溶液中,H2O2分解机理为:
H2O2 + I- = H2O + IO-慢
H2O2 + IO-= H2O + O2 + I- 快
下列说法正确的是( )
- A、 IO-是该反应的催化剂
- B、 反应的速率与I-浓度有关
- C、 ν(H2O2) =ν(H2O) =ν(O2)
- D、 反应活化能等于98kJ/mol
下列有关水处理的离子方程式错误的是( )
- A、 沉淀法:加入Na2S处理含Hg2+废水,Hg2++ S2- =HgS
- B、 中和法:加入生石灰处理酸性废水,H++ OH- =H2O
- C、 氧化法:加入次氯酸处理氨氮废水,2NH4++3HClO =N2↑+3H2O+5 H++ 3Cl-
- D、 混凝法:加入明矾[K2SO4·Al2(SO4)3·24H2O]使水中的悬浮颗粒发生凝聚,Al3++3H2O =Al(OH)3+3H+
Cl2是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式错误的是( )
- A、 电解饱和食盐水制取Cl2:2Cl- +2H2O
2OH-+ H2↑+Cl2↑
- B、 氯气用于自来水消毒:Cl2 + H2O
 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO- - C、 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 = 6 NH4Cl + N2
- D、 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O = SO42-+ 3H+ + 2Cl-
下列反应的离子方程式书写正确的是( )
- A、 Na2CO3 溶液中滴入少量盐酸:CO32-+2H+→CO2↑+H2O
- B、 铁粉与稀 H2SO4反应:2Fe+6H+→2Fe3++3H2↑
- C、 Cu(OH)2与稀 H2SO4反应:OH-+H+→ H2O
- D、 氯气与氢氧化钠溶液反应 Cl2+2OH‾→ClO‾+Cl‾+H2O
下列指定反应的离子方程式正确的是( )
- A、 向偏铝酸钠和碳酸钠的混合溶液中滴加少量盐酸:AlO2-+ H++H2O=Al(OH)3 ↓
- B、 将少量SO2 通入次氯酸钠溶液:ClO-+SO2+H2O=2H++Cl-+SO42-
- C、 向碘化亚铁溶液中滴加少量稀硝酸:NO3-+3Fe2++4H+=3Fe3++ NO↑+2H2O
- D、 向氯化铝溶液中滴加硫化钠溶液:3S2-+2Al3+=Al2S3↓
A、B、C、D、E 五种物质中均含有同一种短周期主族元素R, 它们能发生如图所示的转化关系,已知A、B、D、E四种物质均难溶于水,单质R能与NaOH溶液反应生成盐和氢气。

下列说法正确的是( )
- A、 反应①中氧化剂与还原剂的物质的量之比为1∶1
- B、 化合物A既能溶于NaOH又能溶于氢氟酸
- C、 反应④的离子方程式为:2R+2OH-+2H2O=2RO2-+3H2↑
- D、 化合物C的溶液与反应①产生的气体能够发生化学反应