选择题
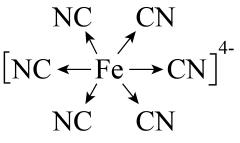
亚铁氰化铁又名普鲁士蓝,化学式为 , 是一种配位化合物,可以用来上釉、用作油画染料等。下列有关普鲁士蓝构成微粒的符号表征正确的是( )
, 是一种配位化合物,可以用来上釉、用作油画染料等。下列有关普鲁士蓝构成微粒的符号表征正确的是( )
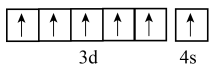
- A、 基态
的价电子排布图为
- B、 氮原子的结构示意图为

- C、
的电子式为
- D、 阴离子的结构式为
下列表达方式或说法正确的是( )
- A、 NH3、H2O、CO2、HCl四分子中孤电子对最多的是CO2
- B、 氯化铵的电子式:
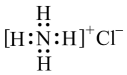
- C、 硫离子的核外电子排布式 1s22s22p63s23p4
- D、 基态到激发态产生的光谱是发射光谱
下列对有关事实的解释正确的是( )
选项 | 事实 | 解释 |
A | NH3的热稳定性比PH3强 | NH3分子间能形成氢键 |
B | 基态Fe3+比Fe2+稳定 | 基态Fe3+价电子排布式为3d5 , 是半充满的稳定结构 |
C | 石墨能够导电 | 石墨是离子晶体 |
D | CH4与H2O分子的空间构型不同 | 它们中心原子杂化轨道类型不同 |
- A、 A
- B、 B
- C、 C
- D、 D
下列说法错误的是( )
- A、 石墨晶体中层内导电性强于层间导电性
- B、 基态Cr3+的最高能层中成对电子与未成对电子的数目比为8∶3
- C、 (CH3COO)2Ni·4H2O的空间构型为八面体,中心离子的配位数为6
- D、 N元素的电负性比P元素的大,可推断NCl3分子的极性比PCl3的大
下列化学用语表达正确的是( )
- A、 基态硫原子的轨道表示式:
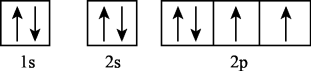
- B、
的电子式:
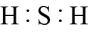
- C、
的VSEPR模型:

- D、
的分子的空间结构模型
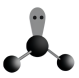
下列有关化学用语表示正确的是( )
- A、 次氯酸的电子式:

- B、
的结构示意图:
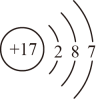
- C、 基态碳原子价层电子轨道表示式为:
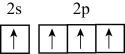
- D、 四氯化碳的空间填充模型:

下列化学用语使用正确的是( )
- A、 氯气的共价键电子云轮廓图:

- B、 基态
的价层电子排布图:
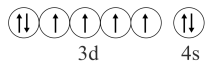
- C、 用电子式表示
的形成过程:

- D、
的空间填充模型:
下列有关物质结构与性质的说法中正确的是( )
- A、 碳正离子
呈平面三角形
- B、
是第四周期未成对电子数最多的元素
- C、 物质的熔沸点:
(金刚石)
- D、 冰分子中的化学键-氢键可以表示为
尿素[ ]可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为
]可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为 。下列说法错误的是( )
。下列说法错误的是( )
- A、 电负性:
- B、 基态
电子排布式为
- C、
与尿素分子中的N原子杂化方式相同
- D、 C、N原子中电子占据能量最高的轨道形状相同
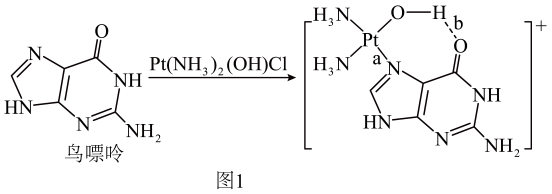
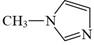
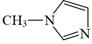
咪唑是分子结构中含有两个间位氮原子的五元芳杂环化合物,该类化合物在医学上有着重要的用途。如:咪唑( 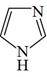 )和N-甲基咪唑(
)和N-甲基咪唑(  )都是合成医药中间体的重要原料,下列有关说法错误的是( )
)都是合成医药中间体的重要原料,下列有关说法错误的是( )
- A、 基态N原子的价电子轨道表示式
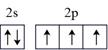
- B、
 与
与 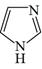 中C、N原子均在同一平面上
中C、N原子均在同一平面上 - C、
 与
与 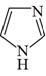 中含σ键个数比为3:2
中含σ键个数比为3:2 - D、
 与
与 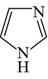 中的N原子均采取sp2杂化
中的N原子均采取sp2杂化
钛酸钙是典型的钙钛矿型化合物,该类化合物具有特殊的理化性质,比如吸光性、电催化性等,其晶体结构如图所示。下列说法正确的是( )

- A、 钛酸钙的化学式为CaTiO2
- B、 晶胞中与每个Ti4+距离最近且相等的O2-有6个
- C、 基态钛原子价电子排布式是4s23d2
- D、 基态Ca2+的核外电子排布式为1s22s2sp63s23p64s2
下列有关化学用语表示正确的是( )
- A、 HClO的电子式:
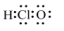
- B、 反-2-丁烯的键线式:

- C、 CO2的空间结构模型:
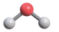
- D、 基态As原子的电子排布式:[Ar]3d104s24p3
下列有关化学用语表示正确的是( )
- A、 NaClO的电子式:

- B、 C原子的一种激发态:
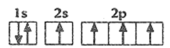
- C、
的结构示意图:
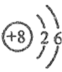
- D、
的基态电子排布式:
侯氏制碱法涉及反应:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓。下列说法正确的是( )
- A、 基态碳原子的轨道表示式:

- B、 NH3中只存在极性共价键
- C、 NH4Cl的电子式:

- D、 NaHCO3的电离方程式:NaHCO3=Na++H++CO
氢氟酸可用于雕刻玻璃,其反应原理为4HF+SiO2=SiF4↑+2H2O。下列有关说法正确的是( )
- A、 HF中的共价键为s-pσ键
- B、 H2O、SiF4均为极性分子
- C、 SiO2晶体为分子晶体
- D、 基态氧原子的价层电子轨道表示式为

铁氮化合物( )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某 的晶胞如图1所示,
的晶胞如图1所示, 可以完全替代该晶体中m位置
可以完全替代该晶体中m位置 或n位置
或n位置 , 形成
, 形成 替代型产物。
替代型产物。 转化为两种
转化为两种 替代型产物的能量变化如图2所示。下列说法错误的是 ( )
替代型产物的能量变化如图2所示。下列说法错误的是 ( )

- A、 与铜同周期且基态原子最外层未成对电子数与基态铜原子相同的元素有3种
- B、
晶胞中
与
之间的最短距离为
- C、 当m位置的
位于体心时,n位置的
位于棱心
- D、 两种产物中,更稳定的
替代型产物的化学式为
下列说法正确的是( )
- A、 NCl3常用于漂白,是由极性键构成的非极性分子
- B、 氮族元素气态氢化物NH3、PH3、AsH3的键角逐渐减小
- C、 CH3Cl分子和COCl2分子中,中心C原子均采用sp3杂化
- D、 元素M的基态原子的核外电子排布式为
, M是一种过渡元素