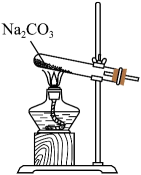
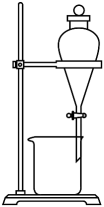
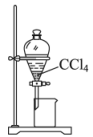
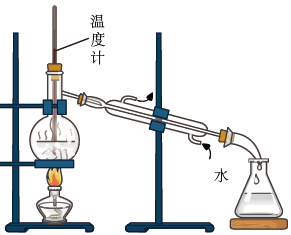
选择题
下列装置可以用于相应实验的是
| A | B | C | D |
|
|
|
|
|
| 制备 | 分离乙醇和乙酸 | 验证 | 测量 |
- A、 A
- B、 B
- C、 C
- D、 D
下列实验中,不能达到实验目的的是( )
由海水制取蒸馏水 | 萃取碘水中的碘 | 分离粗盐中的不溶物 | 由 |
|
|
|
|
A | B | C | D |
- A、 A
- B、 B
- C、 C
- D、 D
化学是以实验为基础的科学。下列实验操作或做法正确且能达到目的的是( )
| 选项 | 操作或做法 | 目的 |
| A | 将铜丝插入浓硝酸中 | 制备 |
| B | 将密闭烧瓶中的 | 探究温度对平衡移动的影响 |
| C | 将溴水滴入 | 萃取溶液中生成的碘 |
| D | 实验结束,将剩余 | 节约试剂 |
- A、 A
- B、 B
- C、 C
- D、 D
已二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线:
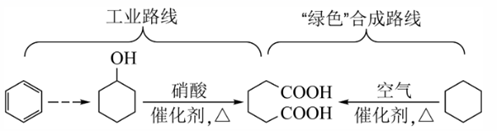
下列说法正确的是( )
- A、 苯与溴水混合,充分振荡后静置,下层溶液呈橙红色
- B、 环己醇与乙醇互为同系物
- C、 已二酸与
溶液反应有
生成
- D、 环己烷分子中所有碳原子共平面
下列操作规范且能达到实验目的的是( )
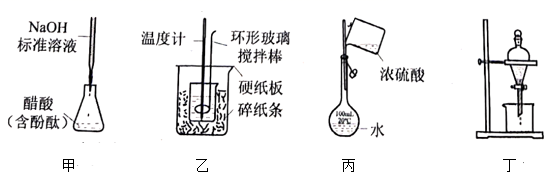
- A、 图甲测定醋酸浓度
- B、 图乙测定中和热
- C、 图丙稀释浓硫酸
- D、 图丁萃取分离碘水中的碘
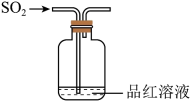
下列实验装置(部分夹持装置略去)正确且能达到相应实验目的的是

- A、 装置Ⅰ利用乙醇提取溴水中的Br2
- B、 利用装置Ⅱ蒸干AlCl3溶液制无水AlCl3固体
- C、 利用装置Ⅲ制备Fe(OH)3胶体
- D、 利用装置Ⅳ验证非金属性S>C>Si
兔年春晚《满庭芳·国色》以中国传统色为切入点,使得桃红、凝脂、群青等有着优美名字的“中国色”扑而而来。其中“桃红”可从红花、铅丹、朱砂或赫石等原料中提取。下列说法错误的是
- A、 提取红花中的有效成分红花素时,可使用萃取操作
- B、 铅丹
中
价
与
价
的个数比为
- C、 以朱砂(主要成分为
)为原料提取的“桃红”不宜用于制作化妆品
- D、 赭石(主要成分为
)可用于制作磁性物质
实验室以含镍废料(主要成分为NiO,含少量FeO、Fe2O3、CoO、BaO和SiO2)为原料,制备NixOy和CoCO3的工艺流程如图所示。

已知:25℃时,Ksp[Co(OH)2]=2.0×10-15.下列说法正确的是( )
- A、 滤渣I中含H2SiO3和BaSO4
- B、 “氧化”、“调pH”时均需加过量的试剂
- C、 “萃取”时,待下层液体从分液漏斗下口流出后,上层液体再从下口放出
- D、 “沉钴”开始时,若溶液中的c(Co2+)=0.02mol·L-1 , 为防止生成Co(OH)2 , 应控制溶液pH<7.5
实验室从海带中提取碘的过程如下:

下列说法正确的是( )

- A、 步骤①⑤分别用装置丙、甲完成
- B、 装置乙使用时先放出下层水溶液,再从上口倒出有机层
- C、 海带中含有的硫酸盐在步骤③中实现与碘的分离
- D、 过程⑦酸化时发生反应的离子方程式:5I-+
+6H+=3I2+3H2O

已知:萃取剂萃取
的原理为
。
- A、 “酸浸”时,为加快浸出速率,提高生产效益,可以使用浓硫酸
- B、 萃取余液可在酸浸中循环利用,反萃取剂X为
- C、 “反萃取”得到的
溶液,在碱性条件下可被
氧化生成
, 该反应的离子方程式为
- D、
溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作可得
, 向冷却结晶后的固液混合物中加入乙醇可提高产率
将浓硫酸、NaBr固体、1-丁醇混合加热回流后,再经洗涤→干燥→蒸馏获得1-溴丁烷,实验中涉及如图装置(部分夹持和加热装置省略)。下列说法错误的是( )

- A、 两处冷凝管冷凝时都利用了气液流向相反,增强冷凝效果的原理
- B、 气体吸收装置的作用是吸收HBr等有毒气体
- C、 经水洗→碱洗→水洗可除去大部分杂质
- D、 1-溴丁烷从分液漏斗的下口放出
下列装置能达到相应实验目的的是( )
去除CO2中少量HCl | 制取氯气 | 分离酒精和水 | 收集NO2 |
|
|
|
|
A | B | C | D |
- A、 A
- B、 B
- C、 C
- D、 D
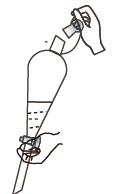
下列图示表示分液操作的是( )
- A、

- B、

- C、

- D、

化学与生产、生活息息相关。下列叙述不正确的是( )
- A、 橱窗所用有机玻璃为高分子化合物
- B、 家庭装修用水性涂料代替油性涂料有利于健康
- C、 应用光伏发电可缓解温室效应及减少酸雨发生
- D、 用己烷萃取玉米胚芽中的油脂时发生了化学反应
可萃取溴水中Br2的试剂是( )
- A、 石蜡
- B、 甘油
- C、 氯仿
- D、 新戊烷
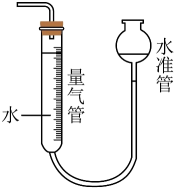
下列有关实验设计不合理的是( )

- A、 图1装置可制取NO气体
- B、 图2装置可以完成“喷泉”实验
- C、 图3证明非金属性强弱:S>C>Si
- D、 图4用四氯化碳萃取碘水中的碘
图示的实验或操作正确的是( )
| A | B | C | D |
| | | | |
| 熔化NaOH | 制取少量 | 萃取振荡时放气 | 分离甲苯和水 |
- A、 A
- B、 B
- C、 C
- D、 D
下列实验操作描述符合题意且能达到实验目的的是( )
| A | B | C | D |
| | | | |
| 苯萃取碘水后的分离操作 | 配制 1 mol/L的NaCl溶液时的定容操作 | 探究接触面积对反应速率的影响 | 验证Ksp(AgSO4)>Ksp(Ag2S) |
- A、 A
- B、 B
- C、 C
- D、 D
下列实验操作描述正确且能达到实验目的的是( )
| A | B | C | D |
| | | | |
| 苯萃取碘水后的分离操作 | 配制 1 mol/L的NaCl溶液时的定容操作 | 探究接触面积对反应速率的影响 | 验证Ksp(AgSO4)>Ksp(Ag2S) |
- A、 A
- B、 B
- C、 C
- D、 D
下列有关实验的操作正确的是( )
| 实验 | 操作 | |
| A | 稀释浓硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B | 除去NaHCO3固体中的少量Na2CO3杂质 | 将固体加热至恒重 |
| C | 浓盐酸与MnO2反应制备纯净Cl2 | 将气体产物先通过盛有浓硫酸的洗气瓶,后通过盛有饱和食盐水的洗气瓶。 |
| D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
- A、 A
- B、 B
- C、 C
- D、 D
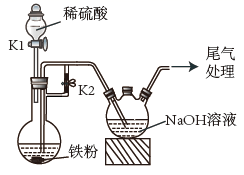
已知实验室按反应C2H5OH  CH2=CH2↑+H2O制备的乙烯中常含有副产物CO2、SO2等。某实验小组利用如下装置制备少量1,2-二溴乙烷:
CH2=CH2↑+H2O制备的乙烯中常含有副产物CO2、SO2等。某实验小组利用如下装置制备少量1,2-二溴乙烷:

下列说法正确的是( )
- A、 浓硫酸主要作氧化剂
- B、 温度计用来指示溶液温度
- C、 装置连接顺序为adebcf
- D、 可采用分液操作分离产品
实验室从废定影液[含Ag(S2O3)  和Br-等]中回收Ag和Br2的步骤是:向废定影液中加入Na2S沉银,过滤、洗涤、干燥,灼烧Ag2S制Ag;制取Cl2并将其通入滤液中氧化Br- , 用四氯化碳萃取分液。其中部分操作的装置如图所示。
和Br-等]中回收Ag和Br2的步骤是:向废定影液中加入Na2S沉银,过滤、洗涤、干燥,灼烧Ag2S制Ag;制取Cl2并将其通入滤液中氧化Br- , 用四氯化碳萃取分液。其中部分操作的装置如图所示。

下列叙述正确的是( )
- A、 用装置甲分离出Ag2S
- B、 用装置乙灼烧Ag2S制取Ag
- C、 用装置丙制备Cl2
- D、 用装置丁分液时,有机相应从下口放出
在海带提碘的实验中可做萃取剂的是( )
- A、 四氯化碳
- B、 水
- C、 乙醇
- D、 乙酸
下列实验能达到实验目的的是( )
| 选项 | A | B | C | D |
| 实验 | | | | |
| 实验目的 | 证明非金属性 | 分离溴苯 | 测定中和热 | 证明 |
- A、 A
- B、 B
- C、 C
- D、 D
为减少环境污染,降低化石燃料消耗,我国正积极推广乙醇汽油。乙醇可由淀粉或纤维素经水解、发酵制得。下列说法错误的是( )
- A、 纤维素的水解反应为取代反应
- B、 可用乙醇做萃取剂,萃取碘水中的碘单质
- C、 可用碘液来检验淀粉是否水解完全
- D、 乙醇可由乙烯与水发生加成反应制取
中国不少古诗词清晰描述了当时人们的生活和社会的发展,如刘禹锡的《浪淘沙》“日照澄洲江雾开,淘金女伴满江隈,美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识认知正确的是( )
- A、 雾的分散质粒子直径范围是1~100nm
- B、 淘金原理与化学上的萃取一致
- C、 沙子的主要成分是
- D、 “沙中浪底来”指的是金的氧化物
中华传统文化源远流长下列对古代著作涉及化学的解读错误的是( )
- A、 “以火烧之,紫青烟起,乃真硝石也”利用的是钾元素的焰色反应
- B、 “落红不是无情物,化作春泥更护花”蕴藏着自然界碳、氮的循环
- C、 “煮豆燃豆其,豆在釜中泣”涉及的能量变化主要是化学能转化为热能
- D、 “日照澄洲江雾开,淘金女伴满江限。美人首饰侯王印,尽是沙中浪底来”诗中淘金原理与化学上的萃取一致
下列四种实验装置,适合用于分离水和植物油的是( )
- A、

- B、

- C、

- D、

下列实验装置或操作与实验目的不相符的是( )
- A、
 证明Cl2氧化性强于Br2
证明Cl2氧化性强于Br2 - B、
 分离乙醇和水
分离乙醇和水 - C、
 除去水中泥沙
除去水中泥沙 - D、
 配制100mL0.100mol/LNaCl溶液
配制100mL0.100mol/LNaCl溶液