选择题Ⅰ(本大题共10小题,每小题2分,共20分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分,请将你认为正确的答案填涂在答题卡相应位置)
胶体有别于其他分散系的本质区别是( )
- A、 分散质粒子大小在1~100 nm
- B、 能透过滤纸
- C、 电泳
- D、 丁达尔效应
下列各组物质中,按沸点由低到高的顺序排列正确的是( )
- A、 H2O、H2S、H2Se、H2Te
- B、 CH4、CCl4、CBr4、CI4
- C、 金刚石、P4、O2
- D、 碳化硅、二氧化硅、晶体硅
下列有关说法正确的是( )
- A、 钢铁发生电化学腐蚀的负极反应式:
- B、 用Pt电极电解一定量的稀硫酸溶液,电解一段时间后溶液的pH值不变
- C、 电解精炼铜时,电解质溶液中
均保持不变
- D、 金属Cu无论在酸性条件下,还是在碱性条件下发生的都是吸氧腐蚀
- A、 标准状况下,
中含有的氯原子数为
- B、
溶液中的
数目为
- C、 密闭容器中,
和
在催化剂作用下充分反应后分子总数为
- D、 1molNa与足量
反应生成
和
的混合物,转移的电子数为
官能团决定有机物的化学特性。下列有机物中,既能使溴水褪色又能跟金属钠反应,还可以和碳酸钠溶液反应的是( )
- A、 CH2=CHCH2OH
- B、 CH2CHCHO
- C、 CH2=CHCOOH
- D、 CH2=CHCOOCH3
下列说法不正确的是( )
- A、 做“海带中碘元素的分离及检验”实验时,须用过量的氯气或双氧水氧化I-
- B、 冷却结晶时,溶液冷却得越快,析出的晶体颗粒就越小
- C、 其他条件相同时,双氧水在碱性溶液中分解速率比在酸性溶液中快
- D、 如果酸液溅入眼内,用大量水冲洗后,立即送医院诊治
下列根据实验现象得出结论不正确的是( )
- A、 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
- B、 向溴水中通入SO2 , 溶液褪色,说明SO2具有漂白性
- C、 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
- D、 向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3
下列离子方程式书写正确的是( )
- A、 白醋与次氯酸钠溶液混合产生黄绿色气体:
- B、 四氧化三铁溶于足量稀硝酸:
- C、 向
溶液中通入过量
:
- D、 向氯化铝溶液中加入过量浓氨水:
金属M在潮湿的空气中会形成一层致密稳定的3M(XY)2•MZX3 , X、Y、Z为短周期主族元素,X的原子序数是Y的8倍,基态X和Z的未成对电子数相同,M是人体必需的元素之一。1molMZX3 , 含有42mol质子,下列说法正确的是( )
- A、 离子半径:M>X
- B、 X、Y、Z的电负性大小为:X>Z>Y
- C、 M的最高价氧化物对应水化物为强碱
- D、 第一电离能:Z>X
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
- A、 使酚酞试液呈红色的溶液中:
、
、
、
- B、 水电离的
mol⋅L
的溶液中:
、
、
、
- C、 明矾溶液中:
、
、
、
- D、
的溶液中:
、
、
、
选择题Ⅱ(本大题共10小题,每小题3分,共30分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分,请将你认为正确的答案填涂在答题卡相应位置)
以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
在5MPa下,按照投料,平衡时,CO和
在含碳产物中物质的量分数及
的转化率随温度的变化如图。下列说法正确的是( )
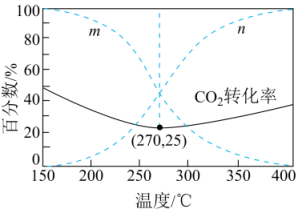
- A、 反应Ⅲ中反应物的总键能大于生成物的总键能
- B、 曲线
代表CO在含碳产物中物质的量分数
- C、 该条件下温度越低,越有利于工业生产
- D、 图示270℃时,平衡体系中
的体积分数约为66.6%
Burns和Dainton研究发现Cl2与CO合成COCl2的反应机理如下:
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是( )
- A、 反应①的活化能大于反应③的活化能
- B、 反应②的平衡常数K=
- C、 要提高合成COCl2的速率,关键是提高反应③的速率
- D、 选择合适的催化剂能提高单位时间内COCl2的产率
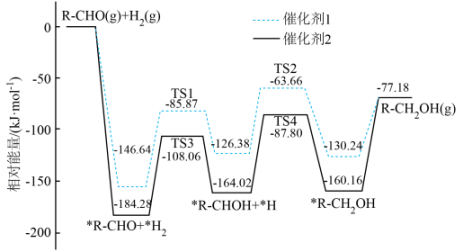
- A、 该反应为放热反应
- B、 催化剂1和催化剂2均降低了反应的焓变
- C、 反应过程中有非极性键的断裂和形成
- D、 催化剂1作用下的决速步为
下列溶液中,加入(或通入)某物质后,发生反应的先后顺序正确的是( )
- A、 在含等浓度的Fe3+、H+、Cu2+的溶液中加入铁粉: Fe3+、H+、Cu2+
- B、 在含等浓度的I-、S2-、Br-的溶液中不断通入氯气:I-、Br-、S2-
- C、 在含等浓度的AlO
、CO
、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO
、CO
- D、 在含等浓度的Mg2+、H+、NH
的溶液中逐渐加入烧碱溶液:Mg2+、NH
、H+
将 溶液滴加到己二酸
溶液滴加到己二酸 溶液中,混合溶液的
溶液中,混合溶液的 与离子浓度变化的关系如图所示。下列叙述错误的是( )
与离子浓度变化的关系如图所示。下列叙述错误的是( )
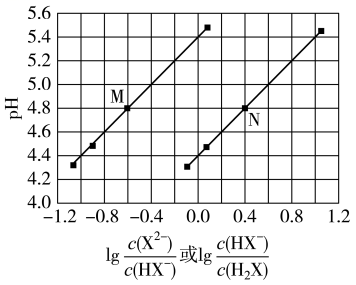
- A、 当混合溶液呈中性时,
- B、 曲线
表示
与
的变化关系
- C、
溶液中
- D、
的数量级为
电解液来源丰富、成本低廉的新型酸碱混合锌铁液流电池的示意图如图,下列说法错误的是( )
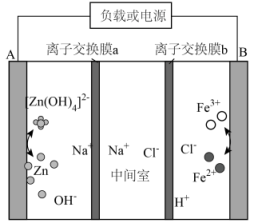
- A、 放电时,电流由B经导线流向A
- B、 放电时,负极反应式为
- C、 离子交换膜a为阳离子交换膜
- D、 充电时,每转移
电子,参与反应的铁元素质量为
向 和
和 的混合物中加入某浓度的稀硝酸
的混合物中加入某浓度的稀硝酸 , 固体物质完全反应,得到标准状况下
, 固体物质完全反应,得到标准状况下 和
和 的混合气体及
的混合气体及 。在所得溶液中加入
。在所得溶液中加入 的NaOH溶液
的NaOH溶液 , 此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
, 此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 。下列有关说法正确的是( )
。下列有关说法正确的是( )
- A、
与
的物质的量之比为
- B、 硝酸的物质的量浓度为2.4mol/L
- C、 产生的
的体积为
(标况)
- D、
、
与硝酸反应后剩余
为
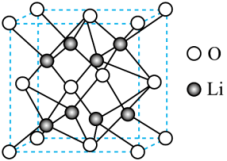

下列说法错误的是( )
- A、 Li的第一电离能为
- B、 Li的配位数为4
- C、
晶格能为
- D、 晶胞参数为anm,则
的密度为
白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。
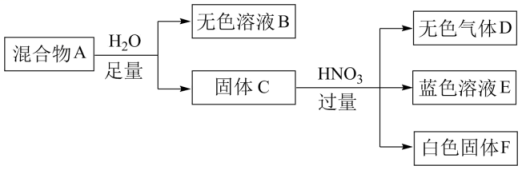
下列推断不正确的是( )
- A、 无色溶液B做焰色反应实验,火焰可能显紫色
- B、 白色固体F的主要成分是H2SiO3
- C、 混合物A中一定含有Na2SiO3、CuSO4和CaCO3
- D、 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3 , 若有白色沉淀生成,说明混合物A中有KCl