选择题

- A、 ①为
的
与
的关系
- B、 b点时,溶液中
- C、
的
- D、 d点时,溶液中存在着
25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )

- A、 图中a=2.6
- B、 25℃时,HCO3-+H2O
H2CO3+OH-的Kh=1.0×10-6.4
- C、 M点溶液中:
- D、 若要表示题目条件下pH与lg
的变化关系.则曲线应该在平行于曲线
的下方
已知草酸( )为二元弱酸,在室温下,向一定浓度的草酸溶液中逐滴加入一定浓度的KOH溶液,溶液中
)为二元弱酸,在室温下,向一定浓度的草酸溶液中逐滴加入一定浓度的KOH溶液,溶液中 、
、 、
、 三种微粒分别在三者中所占的物质的量分数(
三种微粒分别在三者中所占的物质的量分数( )与溶液pH的关系如图所示。下列说法中正确的是( )
)与溶液pH的关系如图所示。下列说法中正确的是( )

- A、 室温时,
的水解平衡常数
- B、 当溶液
时,
- C、 当溶液
时,
- D、 A点溶液加水稀释,则水的电离程度减小
将 溶液滴加到己二酸
溶液滴加到己二酸 溶液中,混合溶液的
溶液中,混合溶液的 与离子浓度变化的关系如图所示。下列叙述错误的是( )
与离子浓度变化的关系如图所示。下列叙述错误的是( )
- A、 当混合溶液呈中性时,
- B、 曲线
表示
与
的变化关系
- C、
溶液中
- D、
的数量级为

- A、
点时:
- B、 水的电离程度:
- C、 滴定过程中,
减小
- D、
、
、
、
均有
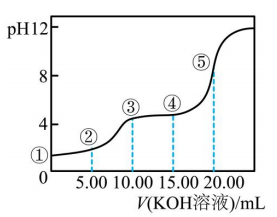
25℃时,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )

- A、 点①所示溶液:c(CH3COO﹣)+c(CH3COOH)=c(Na+)
- B、 点②所示溶液:c(Na+)=c(CH3COO﹣)>c(H+)=c(OH﹣)
- C、 点③所示溶液:c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+)
- D、 滴定终点时:c(CH3COOH)+c(CH3COO﹣)=c(Na+)
常温下,向某浓度的 溶液中逐滴加入已知浓度的NaOH溶液,若pC表示溶液中溶质微粒的物质的量浓度的负对数,则所得溶液中
溶液中逐滴加入已知浓度的NaOH溶液,若pC表示溶液中溶质微粒的物质的量浓度的负对数,则所得溶液中 、
、 、
、 与溶液pH的变化关系如图所示。已知:
与溶液pH的变化关系如图所示。已知:
 ;
;
 。则下列说法正确的是( )
。则下列说法正确的是( )
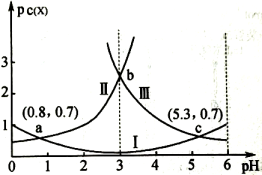
- A、 当pH=3时,溶液中
- B、 常温下,
的数量级为
- C、 常温下,NaHA溶液呈碱性
- D、 常温下随着pH的增大,
的值不变
常温下,在10mL 0.1 MOH溶液中滴加pH=1的盐酸,溶液AG(
MOH溶液中滴加pH=1的盐酸,溶液AG( )与盐酸体积(V)之间的关系如图所示,下列说法不正确的是( )
)与盐酸体积(V)之间的关系如图所示,下列说法不正确的是( )
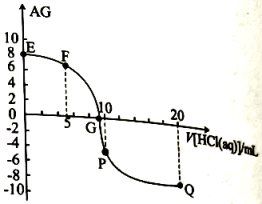
- A、 常温下,MOH的电离常数约为
- B、 F点溶液中:
- C、 滴加盐酸过程中,水的电离程度:P点最大
- D、 Q点溶液中:
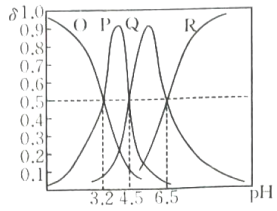
常温下,将等浓度NaOH溶液分别滴加到pH相同、等体积的HBrO溶液、 溶液中,溶液的pH与粒子浓度比值的对数关系如图所示,已知
溶液中,溶液的pH与粒子浓度比值的对数关系如图所示,已知 、
、 , 下列说法正确的是( )
, 下列说法正确的是( )

- A、 a点溶液中
- B、 向HBrO溶液中滴加NaOH溶液至
,
- C、 N表示溶液的pH与
的变化关系
- D、 b点,溶液中由水电离出的
约为
mol/L
常温下,向0.1mol·L1H3PO4溶液中加入NaOH的过程中各微粒的物质的量分数(δ)随pH的变化关系如图所示(H3PO4的三级电离常数依次为Ka1、Ka2、Ka3)。下列叙述错误的是( )

- A、 Ka2=10-7.2 , HPO42-的水解平衡常数为10-6.8
- B、 为获得尽可能纯的NaH2PO4 , pH应控制在4~5
- C、 反应H2PO4-+H2O
 H3PO4+OH- 的K=10-11.9
H3PO4+OH- 的K=10-11.9 - D、 Na2HPO4溶液中存在c(OH-)+c(PO43-)=c(H+)+c(H2PO4-)+c(H3PO4)
常温下,以酚酞为指示剂,用 的NaOH溶液滴定20.00mL
的NaOH溶液滴定20.00mL 的二元酸
的二元酸 溶液.溶液中pH、含A微粒分布系数
溶液.溶液中pH、含A微粒分布系数 (物质的量分数)随滴加NaOH溶液体积
(物质的量分数)随滴加NaOH溶液体积 的变化关系如图所示
的变化关系如图所示
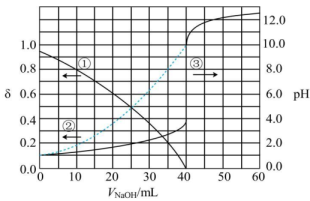
下列说法中正确的是( )
- A、
在水中电离的方程式为:
,
- B、 当
溶液
时,溶液中离子浓度大小顺序为:
- C、 常温下,
的电离平衡常数为
- D、 当
溶液
时,
常温下,用 溶液滴定
溶液滴定 (二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
- A、 点①所示溶液中:
- B、 点②所示溶液中:
- C、 点③所示溶液中:
- D、 点④所示溶液中:
常温下,向 三元酸
三元酸 溶液中滴加
溶液中滴加 的
的 溶液,溶液中含A微粒的物质的量分数
溶液,溶液中含A微粒的物质的量分数 随溶液
随溶液 的变化如图所示,下列说法正确的是( )
的变化如图所示,下列说法正确的是( )
- A、 P为
的物质的量分数与溶液
的关系曲线
- B、 该三元酸的第一步电离是完全的
- C、 常温下,
的水解常数
- D、 当加入
溶液时,溶液显酸性
常温下,向一定体积0.2 的
的 溶液中逐滴滴入0.2
溶液中逐滴滴入0.2 的稀盐酸。溶液中水电离出的氢离子浓度的负对数[用
的稀盐酸。溶液中水电离出的氢离子浓度的负对数[用 表示,
表示, ]与加入盐酸体积的关系如图所示。忽略溶液混合时体积变化和温度变化,已知
]与加入盐酸体积的关系如图所示。忽略溶液混合时体积变化和温度变化,已知 , 下列叙述错误的是( )
, 下列叙述错误的是( )

- A、
的
- B、 c点溶液中水电离出的
- C、 b~c点间溶液中:
- D、 d点溶液中:
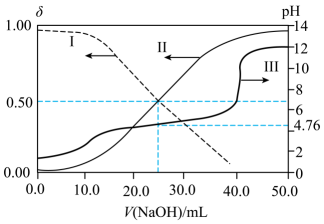
分析化学中“滴定分数”的定义为:所加滴定剂与被滴定组分的物质的量之比。常温下以0.10mol·L-1的HCl溶液滴定同浓度某一元碱MOH溶液并绘制滴定曲线如图所示。下列说法不正确的是( )

- A、 该酸碱中和滴定过程应该选用甲基橙做指示剂
- B、 从x点到z点的整个过程中,y点的水的电离程度最大
- C、 x点处的溶液中满足:c(MOH)+c(OH-)<c(M+)+c(H+)
- D、 根据y点坐标可以算得Kb(MOH)=9×10-7
25℃时,用 盐酸滴定
盐酸滴定 氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数)。下列说法错误的是( )
氨水的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数)。下列说法错误的是( )

- A、 a点溶液中水电离出的
小于
- B、 温度升高,c点溶液的pH减小
- C、 滴定过程,溶液中
不变
- D、 25℃时,
的数量级为
四氯金酸( )由王水和纯金反应制得,可用于工业元件的镀金。常温时,用0.1mol/L的NaOH溶液滴定20mL0.1mol/L的
)由王水和纯金反应制得,可用于工业元件的镀金。常温时,用0.1mol/L的NaOH溶液滴定20mL0.1mol/L的 溶液,滴定过程中测得混合溶液的温度T、NaOH溶液体积V(NaOH)与pH的关系如图所示。下列叙述错误的是( )
溶液,滴定过程中测得混合溶液的温度T、NaOH溶液体积V(NaOH)与pH的关系如图所示。下列叙述错误的是( )

- A、 常温时,四氯金酸(
)的电离平衡常数
约为
- B、 n点溶液中,
- C、 p、n、q三点对应的
水解平衡常数:
- D、 p点对应的溶液中,
乙二酸(用H2A表示)为二元弱酸。25℃时,向0.1mol·L-1NH4HA溶液中滴加适量的0.1mol/L盐酸或0.1mol/LNaOH溶液,溶液中各含氮(或A)微粒的分布分数δ与溶液pH的关系如图所示(不考虑溶液中NH3分子)。例如,溶液中H2A的分布分数 。下列说法不正确的是( )
。下列说法不正确的是( )
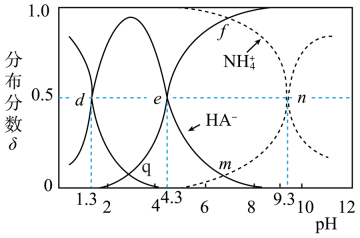
- A、 溶液pH=8时,存在:c(A2-)>c(NH
)>(NH3·H2O)>c(HA-)
- B、 NH4HA溶液中:c(HA-)>c(NH
)>c(H+)>c(OH-)
- C、 n点溶液中存在:c(Na+)+c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1
- D、 2HA-=H2A+A2-的平衡常数K=10-3.0
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图,根据下图图示判断,下列说法正确的是( )

- A、 当V(NaOH溶液)=40 mL时,溶液中离子浓度大小关系:
c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
- B、 NaHA溶液中:c(OH-) + c(A2-) = c(H+) + c(H2A)
- C、 当V((NaOH溶液)=40 mL时,其溶液中水的电离程度比纯水小
- D、 当V((NaOH溶液)=20 mL时,NaHA水解程度大于电离程度
25℃时,等体积两种一元酸HA和HB分别用等浓度的 溶液滴定,滴定曲线如图所示。下列说法正确的是( )。
溶液滴定,滴定曲线如图所示。下列说法正确的是( )。

- A、 酸性:HA<HB
- B、 酸HB的电离度约为0.5%
- C、 起始浓度:
,
- D、 用
溶液滴定HB可用甲基橙作指示剂
已知常温时CH3COOH的电离平衡常数为Ka,该温度下向20mL0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法不正确的是( )

- A、 d点表示的溶液中c(OH-)>c(H+)
- B、 该滴定实验可以用紫色石蕊试液做指示剂
- C、 由图可知0.1 mol/L CH3COOH溶液pH=3
- D、 b、c点表示的溶液中
的值相等
草酸 为二元弱酸,其电离过程为:
为二元弱酸,其电离过程为: ,
,  。常温下向
。常温下向 溶液中逐滴加入
溶液中逐滴加入 溶液,混合溶液中
溶液,混合溶液中 和
和 的物质的量分数(
的物质的量分数( 随
随 变化关系如图所示:
变化关系如图所示:

下列说法正确的是( )
- A、 草酸的一级电离平衡常数的数量级为
- B、 曲线Ⅰ表示
的物质的量分数
- C、 当加入
溶液的体积为
时,溶液中存在如下关系:
- D、
时,对应的溶液中存在关系:
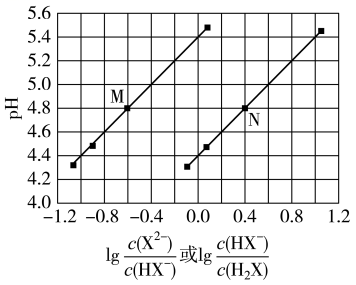
已知 。室温下,向
。室温下,向 一元弱酸HX溶液中逐滴滴加
一元弱酸HX溶液中逐滴滴加 溶液,溶液的
溶液,溶液的 随
随 的变化关系如图所示。下列说法正确的是( )
的变化关系如图所示。下列说法正确的是( )

- A、 当
时,溶液中
- B、 当
时,加入的
溶液体积大于
- C、 当加入
溶液时,溶液中
- D、 a、b、c三点对应溶液中水电离出来的
浓度:a点>b点>c点
室温下,用0.100mol/L NaOH溶液滴定20.00 mL  溶液。滴定过程中含A微粒的分布分数(
溶液。滴定过程中含A微粒的分布分数( )和pH随NaOH溶液体积变化如图所示。下列说法正确的是( )
)和pH随NaOH溶液体积变化如图所示。下列说法正确的是( )
- A、 原
溶液的物质的量浓度为0.125mol/L
- B、 pH=7时,
- C、 加入NaOH溶液越多,
越高,水的电离程度越大
- D、
常温下,用0.1mol·L-1HCl溶液滴定0.1mol·L-1 NH3·H2O溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列说法不正确的是( )
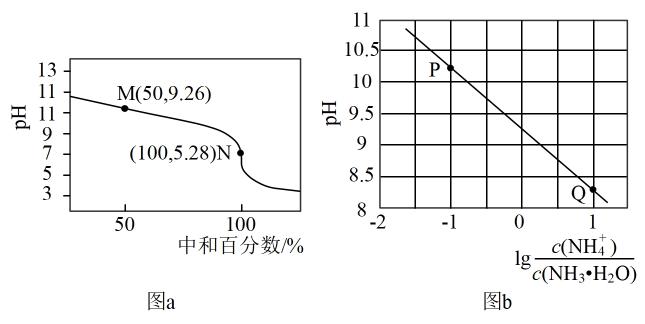
- A、 Kb(NH3·H2O)的数量级为10-5
- B、 P到Q过程中,水的电离程度逐渐增大
- C、 当滴定至溶液呈中性时,c(NH4+)>c(NH3·H2O)
- D、 N点,c(Cl- ) - c(NH4+)=
常温时,用 溶液滴定二元酸
溶液滴定二元酸 溶液,溶液中含A微粒的分布系数
溶液,溶液中含A微粒的分布系数 随pH的变化关系如图所示,[如
随pH的变化关系如图所示,[如 的分布系数:
的分布系数: ]。下列说法错误的是( )
]。下列说法错误的是( )
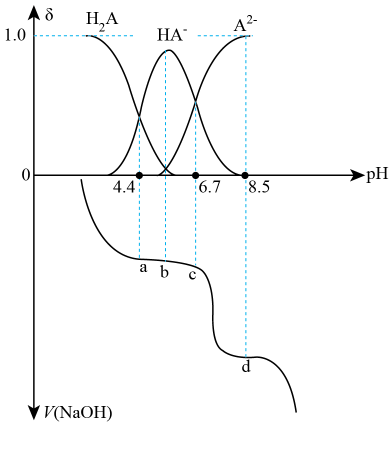
- A、 第二次突变时,可选用酚酞作指示剂
- B、
溶液中存在:
- C、 c点存在:
- D、
的平衡常数
向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中各种含磷微粒的物质的量分数 的变化如图所示。下列说法错误的是( )
的变化如图所示。下列说法错误的是( )
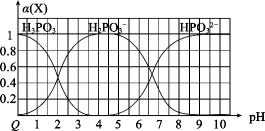
- A、 H3PO3是二元弱酸
- B、 该温度下,H3PO3的Ka1=1.0×10-2
- C、 NaH2PO3溶液显碱性
- D、 以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式为:H2PO
+OH-=H2O+HPO
常温下,用 的盐酸分别滴定20.00mL浓度均为
的盐酸分别滴定20.00mL浓度均为 的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( )
的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是( )

- A、
的NaX溶液中:
- B、 三种一元弱酸的电离常数:
- C、 当
时,三种溶液中:
- D、 分别滴加20.00mL盐酸后,再将三种溶液混合:
已知 ;常温下,用
;常温下,用 溶液分别滴定
溶液分别滴定 浓度均为
浓度均为 的
的 溶液和
溶液和 溶液,所得滴定曲线如下图所示,用
溶液,所得滴定曲线如下图所示,用 代表
代表 或
或 , 用
, 用 代表
代表 或
或 , 下列说法正确的是( )
, 下列说法正确的是( )
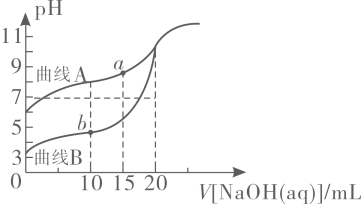
- A、 曲线
表示
溶液滴定
溶液的滴定曲线
- B、 点
存在
- C、 点
存在
- D、 若两份溶液滴定都采用甲基橙作为指示剂,则滴定终点消耗氢氧化钠溶液的体积均偏大
常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1 HA溶液和HB溶液,所得滴定曲线如图所示(其中HA的滴定曲线部分未画出)。下列说法错误的是( )
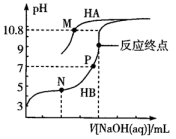
已知:M点溶液中c(A-)=c(HA)
- A、
=105.8
- B、 P点溶液中溶质为NaB和HB,由水电离出的c(H+)=1.0×10-7 mol·L-1
- C、 M点溶液中,2c(Na+)>c(HA)+c(A-)
- D、 等体积等浓度的HB溶液和NaA溶液混合后的溶液中:c(OH-)<c(H+)
25℃时,往20.00mL0.1mol/LHA溶液中滴入0.1mol/LNaOH溶液,体系中-lgc(HA)、-lgc(A-)、NaOH溶液的体积与溶液pH的关系如图所示。下列说法不正确的是( )

- A、 曲线①表示-lgc(HA)与溶液pH的关系
- B、 a点对应的溶液中:2c(H+)+c(HA)=2c(OH-)+c(A-)
- C、 b点对应的溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
- D、 25℃时,HA的电离平衡常数的数量级为10-4
室温下,向20 mL 0.05 mol/L的H2X溶液中逐滴加入0.1 mol/L的NaOH溶液,溶液pH随着NaOH溶液体积变化的关系如图所示。下列叙述错误的是( )
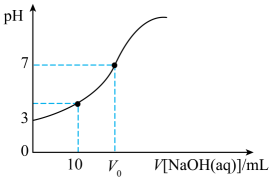
- A、
mL时,溶液中
- B、 随着NaOH溶液的不断加入,水的电离程度先增大后减小
- C、 室温下,
的电离常数
- D、
时,
mL,溶液中