单选题
绿色能源是指使用过程中不排放或排放极少的污染物的能源,下列能源中不属于绿色能源的是( )
- A、 太阳能
- B、 化石能源
- C、 风能
- D、 潮汐能
生产、生活离不开化学,下列说法不正确的是( )
- A、 泡沫灭火器的反应原理是非氧化还原反应
- B、 钢铁析氢腐蚀和吸氧腐蚀的速率一样快
- C、 锅炉水垢中含有的CaSO4 , 可先用Na2CO3溶液处理,后用酸除去
- D、 燃料电池的燃料都在负极发生反应
室温下,0.1mol·L-1下列溶液的pH最大的是( )
- A、 Na2SO4
- B、 NaHCO3
- C、 NH4Cl
- D、 Na2CO3
某温度时水的离子积为1×10-12 , 若该温度下某溶液中的H+浓度为1×10-7mol·L-1 , 则该溶液是( )
- A、 酸性
- B、 碱性
- C、 中性
- D、 无法判断
下列事实可用勒夏特列原理解释的是( )
- A、 使用催化剂有利于加快合成氨反应的反应速率
- B、 H2、I2(g)、HI平衡混合气体加压后颜色变深
- C、 500℃左右比在室温时更有利于提高合成氨的转化率
- D、 配制氯化铁溶液时,将氯化铁固体溶于浓盐酸中,然后加水稀释
下列说法错误的是( )
- A、 S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2 , 则△H1<△H2
- B、 Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-261kJ·mol-1 , 则反应总能量>生成物总能量
- C、 已知C(石墨·s)=C(金刚石·s)△H>0,则石墨比金刚石稳定
- D、 相同条件下,如果1mol氢原子所具有的能量为E1 , 1mol氢分子所具有的能量为E2 , 则2E1=E2
将V1mL1.00mol·L-1HCl溶液和V2mL未如浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )

- A、 做该实验时环境温度为22℃
- B、 该实验表明化学能可以转化为热能
- C、 NaOH溶液的浓度约为1.00mol·L-1
- D、 该实验表明有水生成的反应都是放热反应
室温下将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1 , 将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)═CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
- A、 △H2>△H3
- B、 △H1>△H3
- C、 △H1=△H2+△H3
- D、 △H1+△H2>△H3
下列判断全部正确的一组是:( )
A | B | C | D | |
强电解质 | NaCl | H2SO4 | CaF2 | 石墨 |
弱电解质 | HF | BaSO4 | HClO | NH-H2O |
非电解质 | Cl2 | CS2 | CCl4 | 蔗糖 |
- A、 A
- B、 B
- C、 C
- D、 D
下列事实能说明亚硝酸是弱电解质的是( )
①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1HNO2溶液的pH=2.1
- A、 ①②③
- B、 ②③④
- C、 ①④
- D、 ①②④
下列叙述正确的是( )
- A、 △H>0的化学反应一定不能自发进行
- B、 反应2NO2(g)
N2O4(l)的熵(体系的混乱度)增大(即△S>0)
- C、 FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
- D、 Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
以反应5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
下列说法不正确的是( )
- A、 实验①、②、③所加的H2C2O4溶液均要过量
- B、 实验①测得KMnO4溶液的褪色时间为40s,则这段时间内平均反应速率υ(KMnO4)=2.5×10-4mol·L-1·s-1
- C、 若生成a L CO2(标准状况),该反应转移的电子数为aNA/22.4
- D、 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
- A、 2v(NH3)=v(CO2)
- B、 密闭容器中c(NH3)∶c(CO2)=2∶1
- C、 密闭容器中混合气体的密度不变
- D、 密闭容器中氨气的体积分数不变
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是( )
- A、 4 s时c(B)为0.76mol/L
- B、 830℃达平衡时,A的转化率为80%
- C、 反应达平衡后,升高温度,平衡正向移动
- D、 1200℃时反应C(g)+D(g)
A(g)+B(g)的平衡常数的值为0.4
在密闭容器发生下列反应:aA(g)  cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
- A、 平衡向正反应方向移动
- B、 a<c+d
- C、 D的体积分数增大
- D、 A的转化率变大
下列四个图像所反映的内容与相应反应符合的是(a、b、c、d均大于0)( )
- A、
 4NH3(g)+5O2(g)
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-akJ·mol-1
- B、
 N2(g)+3H2(g)
N2(g)+3H2(g) 2NH3(g)ΔH=-bkJ·mol-1
- C、
 2SO3(g)
2SO3(g) 2SO2(g)+O2(g)ΔH=+ckJ·mol-1
- D、
 2N2O5(g)
2N2O5(g) 4NO2(g)+O2(g)ΔH=+dkJ·mol-1
利用I2O5可消除CO污染,其反应为:反应为I2O5(s)+5CO(g)  5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是( )
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是( )

- A、 b点时,CO的转化率为20%
- B、 容器内的压强保持恒定,表明反应达到平衡状态
- C、 b点和d点的化学平衡常数:Kb>Kd
- D、 0到0.5 min反应速率v(CO)=0.3 mol·L-1·min-1
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
- A、 酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
- B、 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
- C、 酸式滴定管在滴定前有气泡,滴定后气泡消失
- D、 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中不正确的是(忽略混合前后溶液体积变化)( )
- A、 溶液的pH值:②>③>①
- B、 水电离出的c(OH﹣):③>①>②
- C、 ①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO﹣)=0.1mol/L
- D、 ②和③等体积混合后的溶液:c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )

- A、 a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
- B、 a、b两点所示溶液中水的电离程度相同
- C、 pH=7时,c(Na+)=c(A-)+c(HA)
- D、 b点所示溶液中c(A-)>c(HA)
某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是( )
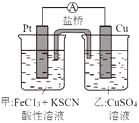
- A、 该原电池的正极反应是Cu2++2e-=Cu
- B、 甲烧杯中溶液的血红色逐渐变浅
- C、 盐桥中的SO42-流向甲烧杯
- D、 若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转
CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是( )
- A、 铜片做阴极,石墨做阳极
- B、 白色沉淀在阴极附近生成
- C、 阳极区溶液变蓝的原因是:2Cu+4I--4e-=2CuI↓+I2 , 碘遇淀粉变蓝
- D、 阳极区溶液变蓝的原因是:4OH--4e-=2H2O+O2↑,O2将I-氧化为I2 , 碘遇淀粉变蓝
亚磷酸(H3PO3)是二元弱酸,亚磷酸主要用作尼龙增白剂,电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图(其中阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法不正确的是( )

- A、 阳极的电极反应式为2H2O-4e-= 4H++O2↑
- B、 产品室中发生的离子反应为HPO32-+2H+=H3PO3
- C、 原料室中Na+浓度保持不变
- D、 阴极室中溶液的pH逐渐升高
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

- A、 t℃时,Y点和Z点时Ag2CrO4的Ksp相等
- B、 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
- C、 t℃时,Ag2CrO4的Ksp为1×10-8
- D、 t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀