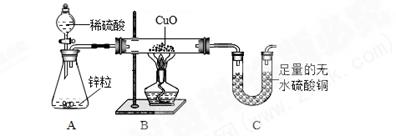
单选题
下列实验设计能达到实验目的的是( )
| 选项 | A | B | C | D |
| 实验设计 |
|
|
|
|
| 实验目的 | 探究碘的溶解性是否与溶剂种类有关 | 探究蜡烛中是否含有氧元素 | 探究可燃物燃烧是否需要氧气 | 探究二氧化碳能否与水反应 |
- A、 A
- B、 B
- C、 C
- D、 D
如图是特色菜“纸锅烧豆腐”。将盛有豆腐、水和调味品的纸锅直接放在固体酒精上烧,发现纸锅不会被烧坏;小明认为是纸锅里的水在沸腾时到达沸点后温度不变,达不到使纸燃烧的温度。下列操作能证明小明观点的是( )

- A、 把空纸锅放在酒精上烧
- B、 把纸锅换成铁锅
- C、 把固体酒精换成煤气灶
- D、 用扇子加大火力
下列实验操作中,能达到实验目的的是( )
| 选项 | 实验目的 | 实验操作 |
| ① | 鉴别厨房里的白酒和白醋 | 加纯碱 |
| ② | 鉴别实验室里的食盐水和蔗糖水 | 品尝味道 |
| ③ | 除去硫酸铜溶液中混有的少量氯化钠 | 加适量的硝酸银溶液、过滤 |
| ④ | 除去NaOH溶液中的少量Na2CO3 | 加适量稀盐酸溶液 |
- A、 ①
- B、 ②
- C、 ③
- D、 ④
如图所示的实验中能够直接用于验证质量守恒定律的是( )
- A、

- B、

- C、

- D、

盐酸除铁锈的实验中气体是怎么产生的?小组同学设计了如图所示的实验。针对该实验的目的,下列评价或改进正确的是( )

- A、 该实验方案完整正确
- B、 应补充铁与水反应的实验
- C、 应补充铁锈与水反应的实验
- D、 应补充铁锈与水反应的实验和补充铁与水反应的实验
为探究饮水机中细菌数量的变化,分别定时从冷、热水口接等量的水,测定结果如下表。下列分析错误的是( )
| 测定时间 | 第一天 | 第四天 | 第七天 | 第十天 |
| 冷水口细菌数(个) | 34 | 560 | 935 | 1220 |
| 热水口细菌数(个) | 15 | 3 | 25 | 46 |
- A、 冷水口接的饮用水细菌数量随时间延长而增多
- B、 使用饮水机喝热水比喝冷水更有利于身体健康
- C、 本实验只探究时间对饮水机中细菌数量的影响
- D、 使用饮水机时,应在保质期内尽快将整桶水喝完
盐酸与生锈的铁钉反应的实验中,小明发现有气体生成,为探究气体产生的原因,小明设计了如下实验:(1)在两支试管分别放入铁粉和铁锈。(2)分别加入等量等浓度的稀盐酸。针对该实验的目的,下列评价或改进正确的是( )

- A、 该实验步骤正确完整
- B、 补充一个铁与水反应的实验
- C、 补充一个铁锈与水反应的实验
- D、 同时补充铁锈、铁与水反应的实验
下列实验能够达到目的的是( )
- A、 除去KNO3溶液中混有的K2SO4 , 加入适量的BaCl2溶液,过滤
- B、 制备Cu(OH)2 , 可将Ba(OH)2溶液和适量CuSO4溶液混合,过滤
- C、 鉴别NaOH、NaCl、CuSO4和稀盐酸四种溶液,不需添加任何试剂就可完成
- D、 除去KCl溶液中的KOH方法:加入过量氯化铜溶液,充分反应后,过滤
按下列实验装置进行相关实验,其中不能达到实验目的是( )
- A、 比较红磷、白磷着火点

- B、 定量测定产生H2的快慢

- C、 除去废气中的CO2 , 并收集CO

- D、 验证CaO和水反应放热

通过如图各实验得出的结论,其中正确的是( )


①既可说明甲烷具有可燃性,又说明了甲烷是由氢元素和碳元素组成
②既可说明二氧化碳的密度比空气大,又说明了二氧化碳不能燃烧也不支持燃烧
③既可说明水是由氢元素、氧元素组成,又说明了水分子中氢原子和氧原子的个数之比为2∶1
④既可说明二氧化碳能溶于水,又说明了二氧化碳具有酸性
- A、 ②③
- B、 ①③④
- C、 ①②③
- D、 ①②③④
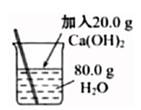
按下列装置实验,能达到对应实验目的的是( )
- A、 收集纯净的H2
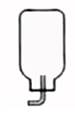
- B、 吸收CO2
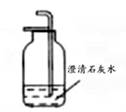
- C、 配制20%的Ca(OH)2溶液
- D、 干燥HCl气体
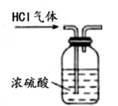
下列实验不能达到目的的是( )
- A、
 检查装置气密性
检查装置气密性 - B、
 比较物质着火点
比较物质着火点 - C、
 监控O2流速
监控O2流速 - D、
 探究微粒运动
探究微粒运动